Capítulo 2 Atmosfera
2.1 Introdução
A atmosfera é o invólucro gasoso de nosso planeta, que se estende desde a superfície terrestre (ao nível do mar) até alguns milhares de quilômetros, cuja função é fundamental para os seres vivos, ao manter as condições ideais na superfície para a criação e manutenção da vida e, também, protegê-lo de agressões externas. Para efeitos didáticos, podemos subdividi-la em cinco camadas, que estão diretamente relacionadas a algumas propriedades físicas e químicas do meio ambiente. Contudo, a divisão feita de acordo com a estratificação térmica é a mais adequada do ponto de vista ambiental.
Como podemos observar na Figura 2.1 a troposfera é a primeira destas camadas e se estende do nível do mar até cerca de 15 km de altitude. A troposfera apresenta uma temperatura inicial próxima à temperatura média global, ou seja, cerca de 15 °C, mas que diminui com o aumento da altitude em decorrência da dissipação do calor proveniente da superfície terrestre na atmosfera. Após a troposfera, temos a estratosfera que se caracteriza por apresentar uma elevação da temperatura com o aumento da altitude. Tal fenômeno é vital para a nossa existência e é causado pela absorção de grande parte da radiação ultravioleta pelas moléculas de ozônio presentes na estratosfera. Contudo, na camada seguinte, denominada mesosfera, a temperatura volta a decrescer com o aumento da altitude devido, principalmente, à diminuição da concentração das moléculas de ozônio nessa camada. A seguir, temos a termosfera e a exosfera que apresentam temperaturas elevadíssimas e crescentes com a altitude devido à absorção da radiação de alta energia de comprimento de onda (cerca de 200 nm). Outra decorrência das elevadas temperaturas dessas camadas é a presença constante de espécies iônicas e atômicas em suas composições.
Além das cinco camadas citadas anteriormente, existem outras três subcamadas que se caracterizam por sinalizar inversões térmicas entre as camadas atmosféricas e apresentar temperaturas relativamente constantes com a altitude. Elas são denominadas tropopausa, estratopausa e mesopausa e complementam, respectivamente, a troposfera, estratosfera e mesosfera (Figura 2.1). A estratopausa é também uma camada muito importante do ponto de vista ambiental, pois é nela que se encontra uma camada rica em O3 (ozonosfera), que protege a Terra da radiação ultravioleta proveniente do Sol.
Dentre todas as camadas citadas anteriormente, apenas a troposfera mantém contato direto com a crosta terrestre. Essa por sua vez é a região responsável pelas mudanças climáticas da terra, pois é nessa camada que se originam praticamente todas as massas de ar (85 a 95% do ar atmosférico). Consequentemente, essa deve proporcionar o ambiente básico para a sobrevivência dos organismos aeróbicos. Em outras palavras, ela é rica em oxigênio livre (O2) para a respiração. Portanto, a troposfera é o principal foco dos estudos ambientais, já que nessa camada ocorre a maioria dos fenômenos relacionados à poluição do ar.
Quanto à composição, a atmosfera não é apenas composta por substâncias no estado gasoso. Ela também é composta naturalmente por alguns materiais sólidos dispersos, tais como: pólen, poeira, micro-organismos, dentre outros. Além disso, a atmosfera é composta também por uma fração de substâncias líquidas dispersas no meio na forma de pequenas gotículas resultantes da condensação do vapor d'água, que formam nuvens, neblinas e chuvas.
Todavia, em termos relativos, a fase gasosa é a que apresenta a maior parcela de constituintes na atmosfera. Como podemos observar na Figura 2.2, essa é composta, aproximadamente, por 78% de nitrogênio (N2), 21% de oxigênio (O2), 0,93% de gases nobres (hélio - He, neônio - Ne, argônio - Ar, criptônio - Kr e xenônio - Xe), 0,03% de gás carbônico (CO2) e 0,04% de outros gases (dióxido de enxofre - SO2, dióxido de nitrogênio - NO2, ozônio - O3, dentre outros).
Embora a composição média da atmosfera permaneça praticamente constante desde o surgimento da vida na Terra, todas as moléculas de gases que a compõem, obedecem a um rigoroso equilíbrio dinâmico, que depende não só de fenômenos físicos, mas também de fenômenos químicos e biológicos. Contudo, as principais alterações ocorridas nos componentes atmosféricos se dão em seus constituintes minoritários, com destaque para as alterações ocorridas na concentração de CO2. Apesar da pequena quantidade, as alterações na concentração dessa substância na atmosfera, proporcionam sérias transformações nas propriedades físicas, químicas e biológicas no meio ambiente.
2.2 Transformações químicas na atmosfera
Podemos fazer uma analogia da atmosfera terrestre como sendo um grande reator químico, em que podemos ter, por um lado, compostos abundantes e altamente reativos, como o oxigênio, além de diversos compostos em pequena concentração que podem atuar como reagentes e/ou catalisadores. Por outro lado, temos a luz solar que pode atuar como fonte de energia e principal responsável pelas transformações químicas dos compostos provenientes da superfície terrestre.
Um dos parâmetros de maior importância para as transformações químicas na atmosfera é a velocidade ou cinética com que elas se desencadeiam, uma vez que muitos compostos podem ter uma velocidade de transformação rápida (na escala de minutos ou horas) ou lenta (na escala de anos). Além disso, a velocidade da reação depende de vários fatores, como concentração dos reagentes, temperatura, catalisador e reatividade da molécula.
A cinética ou capacidade de reação dos compostos na atmosfera é conhecida como tempo de residência e é definida como o tempo médio de permanência do composto na atmosfera.
O tempo de residência é fundamental para estabelecer o raio de ação de um composto, tomando por base o local em que ocorreu a emissão. Para exemplificar sua importância, temos que o tempo de residência do CO2 é de quatro anos, enquanto que o tempo de residência do NO2 é de apenas um dia. Logo, quando emitidos em conjunto, o CO2 alcançará um raio de atuação maior que o NO2, que possui um tempo de permanência na atmosfera de apenas 24 horas.
Os compostos e materiais particulados, que são responsáveis pelas transformações químicas na atmosfera, podem ter procedência natural (superfície do mar, vulcões etc.) ou antrópica (chaminé, motores a combustão etc.). Podem ser oriundos de fontes pontuais, quando a emissão ocorre de um ponto específico, ou de fontes difusas, quando a emissão está espalhada em uma grande área. Por fim, os poluentes podem ser classificados como primários e secundários. Os primários são aqueles lançados diretamente no ar pela emissão direta de fontes naturais ou antrópicas, e os secundários são formados na atmosfera como produtos de uma reação que ocorre devido à presença de certas substâncias químicas e determinadas condições físicas.
Os compostos que chegam ou são formados na atmosfera são consumidos pelos chamados sorvedouros. Existem diversos tipos de sorvedouros naturais, como a chuva, que dissolve gases solúveis na chamada deposição úmida, ou os ventos, que arrastam os compostos em direção ao solo pela chamada deposição seca. Existem também sorvedouros que utilizam mecanismos químicos para a transformação de compostos. Essa sequência de transformações é conhecida como ciclo biogeoquímico e destacamos a seguir os seus três principais atores: o carbono, o enxofre e o nitrogênio.
2.2.1 Ciclo do carbono
O carbono é o elemento químico mais abundante de nosso planeta e por isso está presente na composição de todos os seres vivos. Além disso, o carbono pode estar presente na atmosfera na forma de diferentes compostos que formam o chamado ciclo do carbono. A maioria desses compostos é sintetizada pelos organismos vivos e apresentam um número de oxidação que varia de +4 a -4. Contudo, o carbono com valência +4 é a principal forma transportada no meio ambiente, com destaque para as espécies de dióxido de carbono (CO2), carbonato (CO32−) e bicarbonato (HCO3-). Suas principais reações de formação ou transformação são apresentadas abaixo.
A primeira delas corresponde à absorção de CO2 da atmosfera pelos vegetais durante o processo de fotossíntese:
CO2(g) + H2O(l) + hν ⇌ Cfixado(biomassa) + O2(g)
equação 2.1Em seguida, e não menos importante, temos o processo de respiração celular, responsável pela produção de energia dos seres vivos:
O2(g) + respiração celular ⇌ CO2(g) + H2O(l) + energia
equação 2.2A fotossíntese e a respiração são processos de reciclagem do carbono, em que esse passa de sua fase inorgânica à fase orgânica e volta a fase inorgânica, completando assim o seu ciclo. Essas duas reações podem ser visualizadas na Figura 2.3, a seguir:
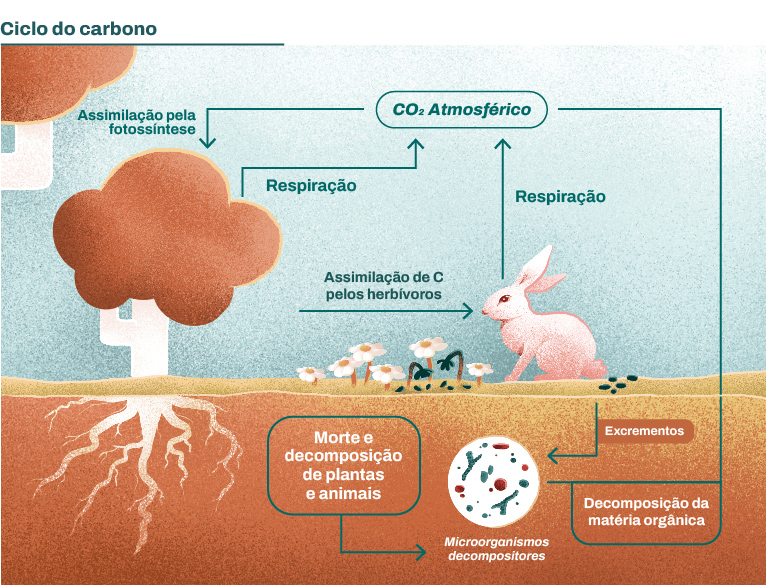
Por fim, temos as reações que participam do mecanismo de transporte do CO2 em meio aquoso e sua interação com íons metálicos:
CO2(g) ⇌ CO2(aq)
equação 2.3CO2(aq) + H2O(l) ⇌ H2CO3(aq)
equação 2.4H2CO3(aq) ⇌ H+(aq) + HCO3-(aq)
equação 2.5HCO3-(aq) ⇌ H+(aq) + CO32−(aq)
equação 2.6CaCO3(s) ⇌ Ca2+(aq) + CO32−(aq)
equação 2.7O equilíbrio envolvendo a dissolução do CO2 em meio aquoso e sua interação com íons metálicos é o principal responsável pela formação de esqueletos e carapaças de alguns organismos com conchas, casca de ovos ou pela formação e dissolução de rochas e sedimentos.
No entanto, este ciclo natural do carbono é significativamente afetado pela emissão de CO2 na atmosfera proveniente da queima de combustíveis fósseis:
Essas emissões são as principais responsáveis pelo aquecimento global.
Estima-se que a quantidade de CO2 emitida na atmosfera apenas com os preparativos e realização da Copa do Mundo de 2014 no Brasil ultrapassou 14 milhões de toneladas, aproximadamente 0,8% das emissões anuais do país.
2.2.2 Ciclo do nitrogênio
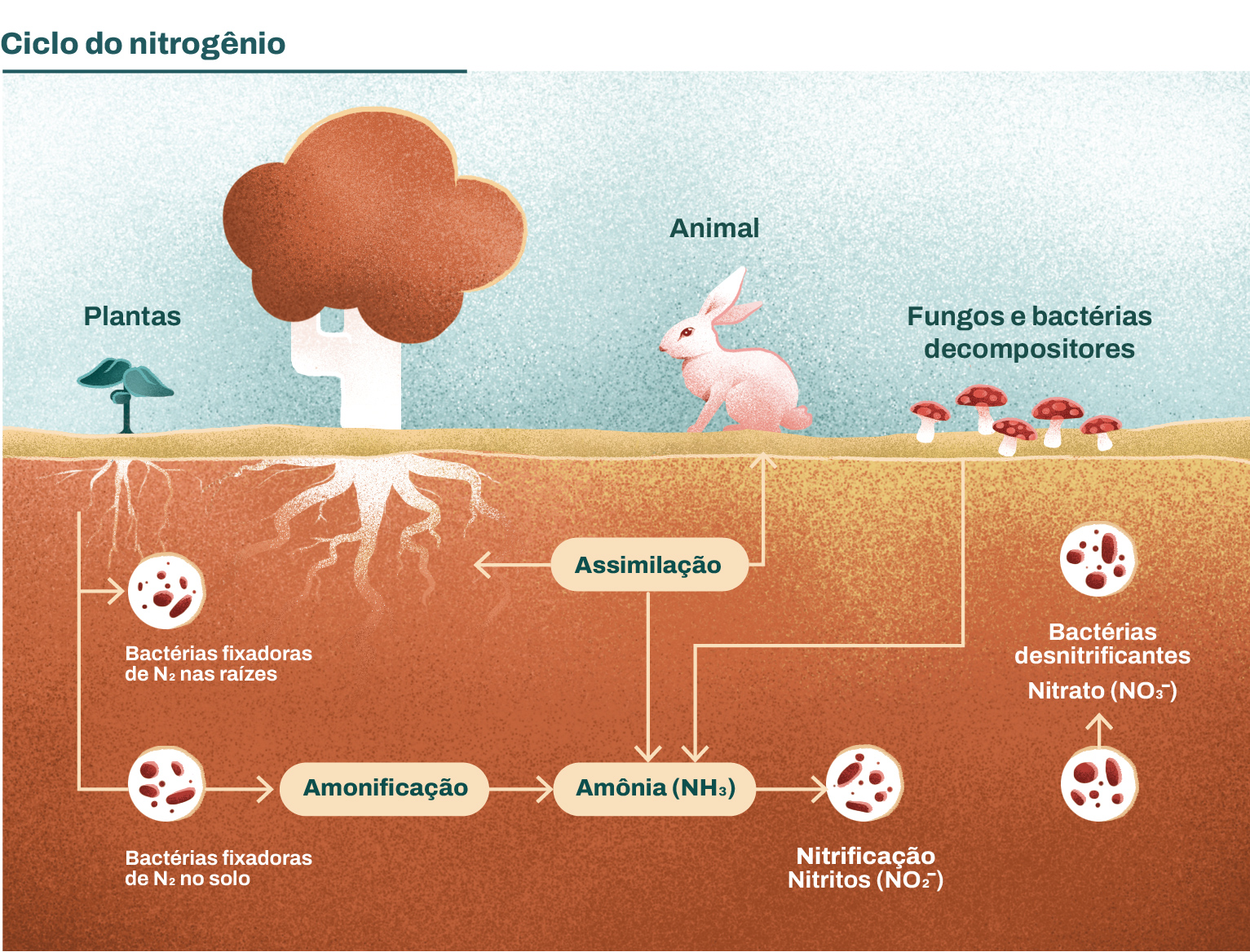
Assim como o carbono, o nitrogênio é um macroelemento essencial para os seres vivos uma vez que é o principal componente dos aminoácidos formadores das proteínas e também dos nucleotídeos, que compõem os ácidos nucleicos. Contudo, dos quase 80% em composição de nitrogênio na atmosfera, apenas 0,02% se encontra disponível para ser utilizado pelas plantas na forma de amônia (NH3) ou nitrato (NO3-). Algumas poucas espécies de micro-organismos conseguem fixar o nitrogênio disponível na atmosfera, sendo as bactérias fixadoras de nitrogênio as mais conhecidas. Ao incorporar os átomos de nitrogênio em suas moléculas orgânicas, esses micro-organismos realizam um processo denominado fixação do nitrogênio.
A fixação do nitrogênio é um processo que envolve muito gasto de energia e que pode ser realizado por bactérias, cianobactérias e algumas espécies de fungos.
A fixação do nitrogênio é feita principalmente por espécies de cianobactérias, bactérias que podem viver livres no solo, como é o caso das bactérias do gênero Azotobacter, e também por outras bactérias que vivem no interior das células de espécies eucarióticas, como as bactérias do gênero Rhizobium, que vivem em mutualismo nas raízes das leguminosas, como feijão, soja, ervilha etc. Alguns fungos fixadores de nitrogênio também podem viver nas raízes de plantas não leguminosas.
O nitrogênio fixado pelos micro-organismos é transformado em amônia (NH3), sendo uma parte fornecida à planta na forma de nitrato e a outra liberada no solo. A amônia que está disponível no solo provém da fixação do nitrogênio pelos micro-organismos fixadores, mas há outra parte que provém da decomposição das proteínas, dos ácidos nucleicos e de resíduos nitrogenados presentes em excretas e cadáveres. Quando a transformação do nitrogênio em amônia é realizada por bactérias, fungos e decompositores esse processo é chamado de amonificação. Nesse processo, bactérias e fungos conseguem a energia necessária para seu metabolismo, em que a decomposição é o produto da respiração celular desses micro-organismos.
Como vimos anteriormente alguns vegetais conseguem aproveitar a amônia diretamente, enquanto que outros empregam o nitrato (NO3-). Ao fenômeno de transformação da amônia em nitrato damos o nome de nitrificação que pode ser subdividida em duas etapas:
I. inicialmente na nitrosação, parte da amônia não aproveitada pelos vegetais é oxidada em nitrito por bactérias nitrificantes do gênero Nitrosomonas, Nitrosococcus e Nitrosolobus. Nesse processo há a liberação de energia e essas bactérias a utilizam na produção de compostos orgânicos.
II. em seguida, temos a nitratação em que os nitritos formados por bactérias nitrosas são eliminados no solo, sendo oxidados por bactérias quimiossintéticas chamadas de nítricas (gênero Nitrobacter). O produto dessa oxidação são os nitratos, que são absorvidos e utilizados pelos vegetais na fabricação de proteínas e ácidos nucleicos. Na cadeia alimentar, esses nitratos são absorvidos pelo organismo dos animais.
Presentes no solo há outros tipos de bactérias, como a Pseudomonas denitrificans, que, na ausência de oxigênio atmosférico, utiliza o nitrato para oxidar compostos orgânicos, produzindo energia pela respiração anaeróbia. A esse processo damos o nome de desnitrificação, e nele uma parte dos nitratos encontrados no solo é transformada novamente em nitrogênio e liberada para a atmosfera, encerrando-se o ciclo e deixando a taxa de nitrato do solo estável. A Figura 2.4, a seguir, representa, de forma resumida, todos os processos que compõem o ciclo do nitrogênio.
O homem moderno alterou esse ciclo pela introdução de grandes quantidades de nitrogênio reativo, que é comumente usado na agricultura como adubo e fertilizante.
O NPK é um dos principais adubos empregados pela agricultura moderna. Como o próprio nome sugere, ele é composto por nitrogênio, fósforo e potássio. O nitrogênio reativo usado na fabricação do NPK é obtido por um processo industrial conhecido como processo Haber-Bosch que emprega nitrogênio atmosférico e gás hidrogênio na síntese catalítica de amônia.
2.2.3 Ciclo do enxofre
O enxofre possui um ciclo biogeoquímico muito complexo. Essa complexidade se deve, em parte, às valências múltiplas apresentadas por esse elemento químico que apresenta uma variação do número de oxidação de −2 até +6.
O ciclo do enxofre é basicamente sedimentar embora possua uma fase gasosa. Nos sedimentos, o enxofre permanece armazenado na forma de sulfato inorgânico. Por meio da erosão, fica dissolvido na água do solo e assume a forma iônica de sulfato (SO42−); sendo assim, facilmente absorvido pelas raízes dos vegetais.
Na atmosfera, o enxofre existe combinado com o oxigênio formando uma parcela de dióxido de enxofre (SO2) e outra parcela de anidrido sulfúrico (SO3). Já o gás sulfídrico (H2S), uma forma bem conhecida do enxofre por gerar um odor de ovo podre, tem tempo de residência curto (cerca de 24 horas) na atmosfera sendo logo transformado em SO2.
Esses óxidos de enxofre (SO2 e SO3) incorporam-se ao solo com as chuvas, sendo então transformados em íons de sulfato (SO42−). Podem, também, ser capturados diretamente pelas folhas das plantas, num processo chamado de adsorção, para serem usados na fabricação de aminoácidos.
O enxofre pode retornar naturalmente para a atmosfera através da ação de decompositores que produzem o H2S. As sulfobactérias realizam o processo inverso, com uma forma de obtenção de energia para a quimiossíntese.
A contribuição das atividades vulcânicas para o acúmulo de enxofre na atmosfera é pouco significativa. Por outro lado, o processo de queima de carvão e óleo combustível em indústrias e usinas interfere diretamente no ciclo, liberando dióxidos de enxofre, que têm potenciais danosos ao organismo, além de provocar, em certas situações, o que se denomina de chuva ácida e o smog industrial. A Figura 2.5, a seguir, apresenta, de forma resumida, todos os processos que compõem o ciclo do enxofre.
Existem diversos outros ciclos de elementos no meio ambiente, tais como os do fósforo, do mercúrio e do oxigênio, contudo, eles não serão abordados nesse estudo devido à sua menor participação na atmosfera.
Atividade 2.1
Pesquise e apresente de forma resumida as reações envolvidas na formação da chuva ácida e do smog industrial.
2.3 A poluição atmosférica
A poluição atmosférica geralmente se refere às substâncias que, em escalas local e regional, afetam diretamente os animais, plantas, seres humanos e estruturas físicas. Esse fenômeno não é recente e já vem atingindo a humanidade há séculos, principalmente nos centros urbanos. Nas últimas décadas, pós-revolução industrial, a poluição atmosférica só tem agravado e gerado grandes discussões da comunidade científica que alerta para seus efeitos adversos. Tais discussões culminaram na assinatura de vários protocolos internacionais com a intenção de mitigar ou resolver alguns dos problemas existentes, como o protocolo de Montreal, que entrou em vigor em 1 de janeiro de 1989. Ele é um tratado internacional que visa a substituição das substâncias que reagem quimicamente com o O3 na parte superior da estratosfera, ou seja, os clorofluorcarbonos, ou simplesmente CFC's, e é considerado um dos protocolos de maior sucesso. Mais recentemente houve a realização da Conferência das Nações Unidas sobre Desenvolvimento Sustentável (CNUDS), conhecida também como Rio+20, entre os dias 13 e 22 de junho de 2012, na cidade brasileira do Rio de Janeiro, cujo objetivo foi discutir sobre a renovação do compromisso político com o desenvolvimento sustentável.
Atividade 2.2
Pesquise e apresente de forma resumida os principais avanços obtidos com a Rio+20.
2.3.1 Principais poluentes atmosféricos e seus efeitos nocivos
Como já vimos, os processos de combustão constituem as grandes fontes de energia e emissão de compostos para a atmosfera no mundo contemporâneo. A combustão é uma reação química exotérmica entre uma substância (o combustível) e um gás (o comburente), geralmente o oxigênio do ar, gerando como produto gases e partículas. A combustão pode ser representado pela seguinte reação:
combustível + ar (O2(g) e N2(g)) → gases (NO(g), SO2(g), CO2(g) etc.) + partículas
equação 2.11Diversas substâncias oriundas da combustão podem poluir o ar, todavia as mais reconhecidas como sendo alvo de medidas de controle são o monóxido de carbono, o dióxido de enxofre, as substâncias orgânicas tóxicas, os materiais particulados, os óxidos de nitrogênio e os compostos orgânicos voláteis. Os quatro primeiros afetam diretamente a saúde humana, e os dois últimos são ingredientes do smog fotoquímico.
Embora esteja presente naturalmente no meio ambiente, o CO é fatal, quando aspirado em excesso, pois pode deslocar a ligação do O2 com a hemoglobina. Em outras palavras, haverá no sangue uma competição entre CO e O2 pelas moléculas de hemoglobina. O problema causado por essa competição reside no fato dos íons Fe2+ ligarem-se mais fortemente ao CO do que ao O2. Com isso, as moléculas de hemoglobina que reagem com CO, dificilmente tornam-se livres, perdendo assim sua função transportadora de oxigênio. Quanto maior a concentração de CO no ar inspirado, maior a quantidade de hemoglobina desativada e, como consequências mais graves, os danos causados à saúde. Embora a principal fonte de CO antropogênico seja o transporte automotivo, ele também pode ser gerado domiciliarmente por fogões e aquecedores quando a combustão é incompleta.
Já o dióxido de enxofre é principalmente gerado pela combustão do carvão de fontes estacionárias e pela fundição de metais ferrosos e não ferrosos, principalmente o cobre. O enxofre presente no carvão é liberado na forma de SO2 em altas temperaturas, contaminando o ar e prejudicando as pessoas que sofrem de doenças respiratórias. Entretanto, os efeitos mais danosos são causados pela adsorção do SO2 pelos materiais particulados finos, quando aspirados pelo homem. Esses podem reagir com a água formando o ácido sulfúrico que irrita os capilares sanguíneos da região pulmonar, fazendo com que inchem e bloqueiem a passagem de ar. Como vimos no ciclo do enxofre, o aerossol de ácido sulfúrico também é o principal responsável pela chuva ácida, danificando monumentos de mármore e granitos e também acelerando a corrosão do ferro em estrutura metálica.
CaCO3(s) + 2H+(aq) ⇌ Ca2+(aq) + CO2(g) + H2O(l)
equação 2.122Fe(s) + O2(g) + 4H+(aq) ⇌ 2Fe2+(aq) + 2H2O(l)
equação 2.13As substâncias orgânicas tóxicas persistentes são nocivas aos seres humanos e outras espécies. Elas são usualmente criadas pelo próprio ser humano em suas atividades antrópicas (dioxinas, furanos e bifenilas policloradas) e são dispersas e transportadas pelo ar sendo depositadas e distribuídas pela cadeia alimentar. Já os aldeídos de cadeia curta, o benzeno e os hidrocarbonetos policíclicos aromáticos (HPA) atuam como poluentes diretos do ar.
O formaldeído (CH2O) é uma molécula reativa, classificada como um carcinógeno em potencial, que irrita os olhos e os pulmões em concentrações pouco acima de 0,1 ppm. Embora os níveis de aldeídos emitidos na atmosfera sejam baixos, há preocupação de que possam aumentar devido às emissões provenientes da oxidação parcial do metanol e a queima de etanol, que libera quantidades significativas de acetaldeído e que possui propriedades tóxicas semelhantes.
O benzeno é uma das poucas substâncias químicas reconhecidas pela sua ação carcinogênica e mutagênica, não havendo uma concentração ambiente totalmente segura. Ele é considerado um dos agentes causadores da leucemia humana e faz parte da lista das 20 substâncias mais perigosas, segundo o Departamento de Saúde dos Estados Unidos. Os maiores responsáveis pela emissão de benzeno na atmosfera são os processos industriais (14%) e a fumaça proveniente da queima de motores automotivos (82%). Contudo, o uso de benzeno é rigorosamente controlado no ambiente de trabalho e em muitas aplicações ele vem sendo substituído por benzenos alquilados, que são menos tóxicos.
Pior que a ação carcinogênica causada por uma única molécula de benzeno é o resultado oriundo de quatro ou mais moléculas de benzeno unidas como podemos observar nos HPAs, que são subprodutos oriundos da queima de combustível de carbono e estão presentes nos gases de exaustão de automóveis e na fumaça proveniente da queima do carvão ou madeira.
As partículas atmosféricas apresentam vários tamanhos: a maioria é visível na forma de fumaça, contudo, uma pequena parte é invisível a olho nu. Elas penetram nos pulmões, bloqueando e irritando as passagens de ar e podem provocar efeitos tóxicos. Como exemplos a doença do pulmão negro causada nos mineradores de carvão, a fibrose pulmonar causada nos operários que lidam com amianto e o enfisema pulmonar que é comum em habitantes de regiões urbanas densamente povoadas. As partículas de fuligem constituem um problema à parte, pois são capazes de adsorver quantidades significativas de substâncias químicas tóxicas em suas superfícies irregulares.
Na reação entre os óxidos de nitrogênio e compostos orgânicos voláteis (VOCs), na presença de luz solar, sendo esses últimos liberados na queima incompleta e evaporação de combustíveis e solventes, o principal produto é o ozônio, utilizado como parâmetro indicador da presença de oxidantes fotoquímicos na atmosfera. Tais poluentes formam a chamada névoa fotoquímica ou “smog fotoquímico”, que possui este nome porque causa na atmosfera uma diminuição da visibilidade, uma névoa de cor marrom que cobre muitos centros urbanos pelo mundo. Além de prejuízos à saúde, o ozônio pode causar danos à vegetação. O ozônio encontrado na faixa de ar próxima do solo (onde respiramos) é tóxico, e, portanto, chamado de "mau ozônio". Entretanto, na estratosfera (a cerca de 30 km de altitude) o ozônio tem a importante função de proteger a Terra, como um filtro, dos raios ultravioletas emitidos pelo Sol. Os óxidos de nitrogênio e os compostos orgânicos voláteis não constituem poluentes diretos do ar, pois raramente afetam diretamente a saúde humana.
As reações atmosféricas dos hidrocarbonetos, do ozônio, do NO e NO2 que estão envolvidas na formação do smog fotoquímico estão descritas abaixo:
1. Reação fotoquímica com produção de átomos de oxigênio, com comprimento de onda menor que 420 nm:
NO2(g) + hν → NO + O
equação 2.142. Reação entre as espécies de oxigênio, em que M é uma espécie que absorve energia:
O + O2(g) + M → O3(g) + M
equação 2.15O3(g) + NO → NO2(g) + O2(g)
equação 2.163. Produção de radicais livres orgânicos a partir de hidrocarbonetos (RH), em que R• é um radical livre que contém ou não oxigênio:
O + RH → R• + outros produtos
equação 2.17O + CH4(g) → H3C• + HO•
equação 2.18O3(g) + RH → R• + outros produtos
equação 2.194. A propagação da reação acontece por meio de uma variedade de reações tais como:
NO + ROO• → NO2(g) + outros produtos
equação 2.20NO2(g) + R• → produtos como por exemplo PAN (peróxido de acetil nitrato)
equação 2.21Desenvolvendo e aplicando o conhecimento
1. Baseado na Figura 2.1 descreva a correlação existente entre as camadas atmosféricas e a variação da temperatura com a altitude.
2. O que é o tempo de residência e qual a sua aplicabilidade para as transformações na atmosfera?
3. Apresente os três ciclos biogeoquímicos destacados neste capítulo.
4. Por que o protocolo de Montreal é considerado um marco no controle da poluição atmosférica?
5. Cite os principais poluentes atmosféricos e alguns de seus efeitos nocivos.
6. Por que os óxidos de nitrogênio e os compostos orgânicos voláteis não são considerados poluentes diretos do ar?
Referências
BAIRD, C.; CANN, M. Química Ambiental. 4a edição. Porto Alegre: Bookman, 2011.
SPIRO, T. G.; STIGLIANI, W. M. Química Ambiental. 2a edição. São Paulo: Pearson Pretice Hall, 2009.
ROCHA, J. C.; ROSA, A. H.; CARDOSO, A. A. Introdução à Química Ambiental. 2a edição. Porto Alegre: Bookman, 2009.