Capítulo 3 Recursos Hídricos
3.1 Introdução
A água é essencial para todas as formas conhecidas de vida, importante nos mais diversos setores e também no clima terrestre. Dessa forma, na economia mundial, é utilizada pela indústria como solvente para uma grande variedade de substâncias químicas, e também nos processos de refrigeração e transporte de bens comerciais. Na agricultura, a demanda por água aumenta conforme o crescimento da população, pois há a necessidade de mais alimentos. No organismo vivo, age de forma a regular a temperatura, a diluir os sólidos e a transportar tanto os nutrientes que lhe serão úteis quanto os resíduos que serão posteriormente eliminados por esse.
Ao reservatório que agrega todos os tipos de água existentes no planeta Terra é dado o nome de Hidrosfera que contém aproximadamente 1,4 x 109 Km3 de água: 97% das águas superficiais nos oceanos, 2,4% correspondem às geleiras e calotas polares e a pequena fração restante (0,6% da água do planeta) compõe-se de águas subterrâneas nas formações geológicas, lagos, rios, atmosfera, solos, plantas e animais.
Embora a água doce seja essencial para os humanos, são os oceanos que têm um papel vital na manutenção da vida, como um todo, no planeta Terra, pois representam um grande potencial energético que deve ser explorado, uma fonte de alimentos a ser sustentada e também um aliado ao clima, por meio da absorção de grandes quantidades de dióxido de carbono da atmosfera. Atualmente, importantes estudos estão sendo realizados para prever a influência do aquecimento global na circulação oceânica e assim na transferência de calor na Terra, e sua consequente ação sobre o clima.
Outro fato, relacionado à água doce a ser destacado diz respeito à sua potabilidade. Hoje, há uma correlação direta entre o acesso à água potável e o PIB per capita. Embora esse acesso tenha melhorado continuamente e substancialmente nas últimas décadas em quase todas as partes do mundo, alguns pesquisadores estimam que em um tempo relativamente curto, metade da população mundial sofrerá com a escassez de água potável. Dessa forma, a utilização consciente da água doce se faz cada vez mais necessária, por isso novas tecnologias estão sendo estudadas para minimizar o seu consumo. Na agricultura, os processos de irrigação, como o nivelamento do terreno a ser cultivado tem contribuído para uma maior conservação da água, sendo que iniciativas como essas minimizam os problemas causados pelo uso excessivo de água para esta finalidade. Isso é imprescindível porque uma série de distúrbios ecológicos está associada com a construção de represas, diques e barragens necessárias para canalizar as águas superficiais destinadas à irrigação.
Deve-se destacar, ainda, que a água existe na natureza nos diferentes estados da matéria: sólido, líquido e gasoso. A coexistência desses três estados implica em transferências contínuas de um estado para outro, numa sequência fechada de fenômenos designada como ciclo hidrológico. O ciclo hidrológico é, pois, um dos pilares fundamentais do ambiente, assemelhando-se, seu funcionamento, a um sistema de destilação global. A seguir será enfatizado o ciclo hidrológico (ciclagem de água entre os vários reservatórios) que é um processo conhecido e muito dinâmico.
3.2 Ciclo Hidrológico
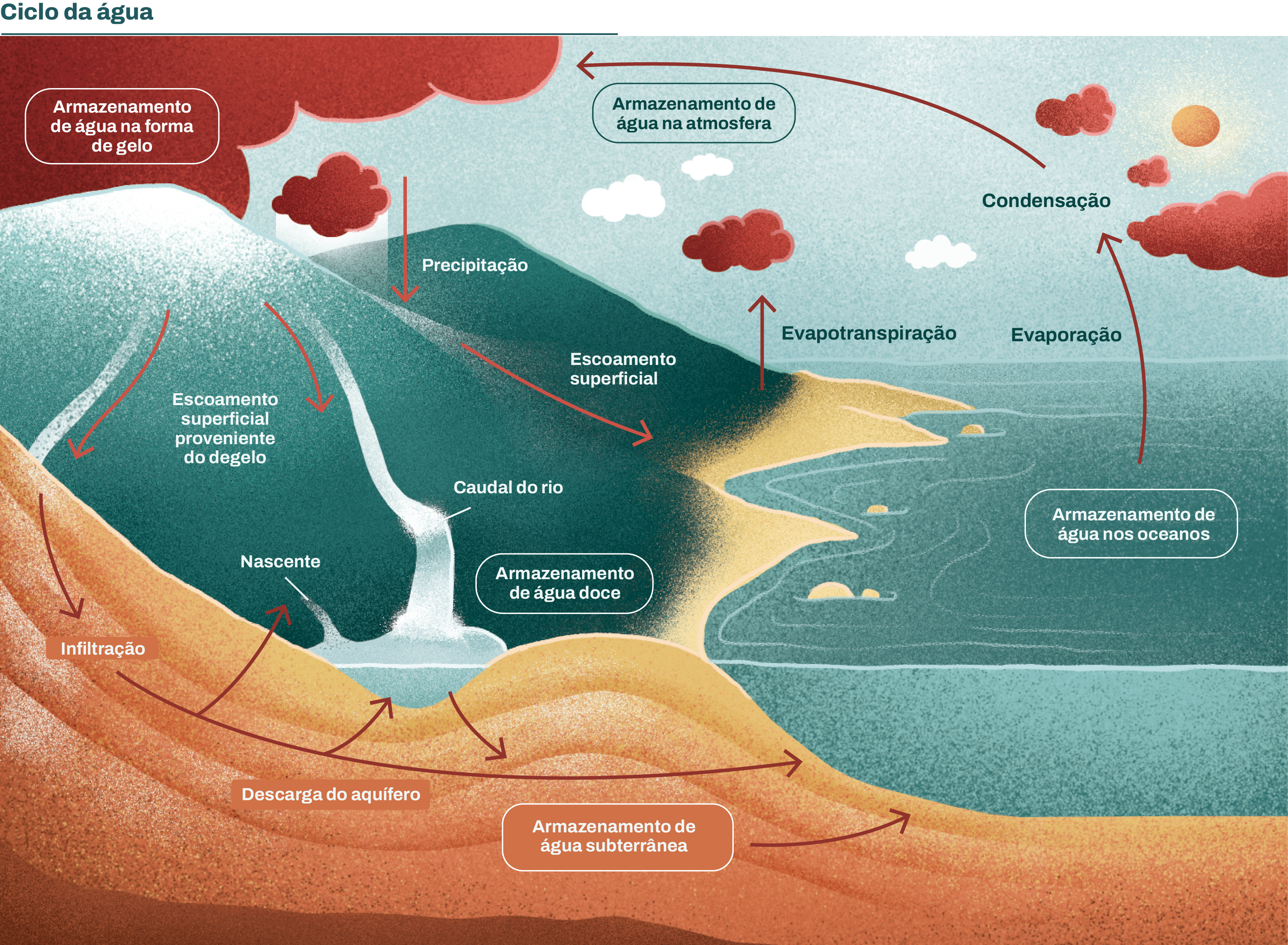
O ciclo hidrológico está associado ao movimento e à troca de água nos seus diferentes estados físicos na hidrosfera com a atmosfera. Essa movimentação deve-se ao Sol, que fornece a energia para elevar a água da superfície terrestre para a atmosfera (evaporação). A transferência processa-se por evaporação direta, pela transpiração das plantas (a vegetação tem um papel importante neste ciclo, pois uma parte da água que cai é absorvida pelas raízes e acaba por voltar à atmosfera pela transpiração) e também por sublimação (que é a passagem direta da água da fase sólida para a gasosa). De um modo geral, a água evapora, em particular, nas regiões mais quentes da Terra. Com isso, há o aquecimento das regiões tropicais devido à radiação solar que provoca a evaporação contínua da água dos oceanos. Em seguida, ela é transportada sob a forma de vapor pela circulação geral da atmosfera, para outras regiões. Esse fato ilustra muito bem a forte interação que há entre o oceano e a atmosfera. Há também o fato de que como os ventos e as águas na superfície se movem relativamente devagar, o movimento de rotação da Terra contribui para provocar a circulação da atmosfera e do oceano.
Correntes marítimas
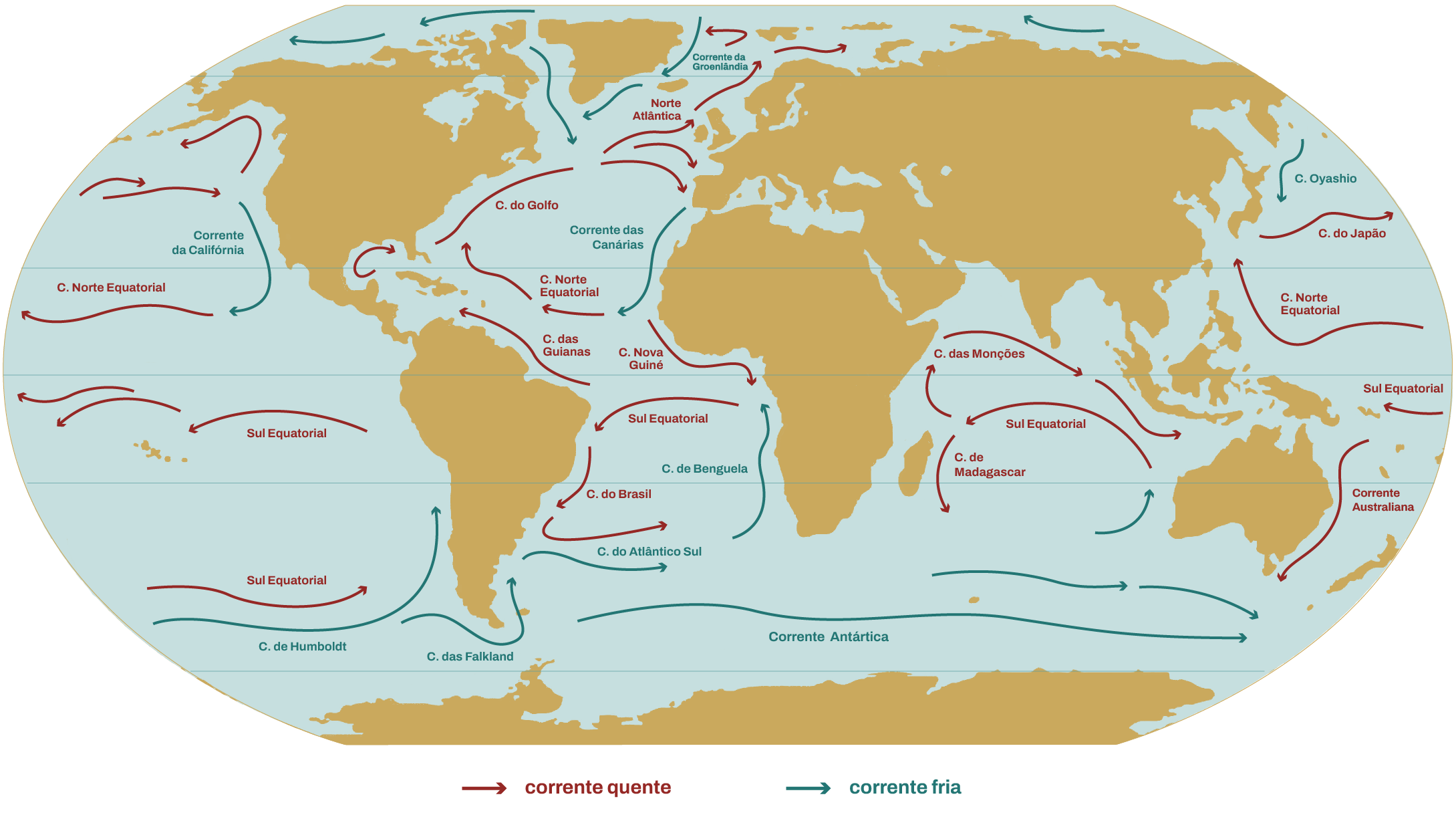
As principais correntes marinhas quentes e frias na superfície do oceano são mostradas na figura 3.2. e correspondem às observações médias realizadas por longo período de tempo, mas deve-se considerar que existe ainda a possibilidade de variações locais. De forma geral, tem-se que as correntes superficiais dos oceanos seguem um padrão circular movido por ventos tropicais que sopram do leste para o oeste em uma faixa equatorial. Quando essas correntes chegam ao continente, se subdividem e uma parte move-se para o hemisfério norte ( sentido horário) e a outra para o hemisfério sul (sentido anti-horário) em virtude da rotação da Terra. Na Antártica, por causa do mar aberto, há uma corrente que flui continuamente do oeste para o leste. Já no oceano Índico, a circulação é complicada pelas variações sazonais devido às monções.
De forma geral, as águas superficiais se resfriam à medida que se afastam do Equador e o termoclino (gradiente de temperatura) desaparece na região próxima aos pólos, permitindo que as águas superficiais se misturem às águas profundas. Existe também o fato de que a superfície se torna mais salina próxima aos polos devido ao congelamento da água. Como a densidade aumenta com o teor salino, há um movimento descendente das águas polares. Como consequência existe uma circulação entre as águas superficiais e profundas que se compara a uma corrente transportadora. Essa corrente é chamada de circulação termohalina, pois depende da temperatura (“termo”) e também do sal (“haleto”) da água. De forma geral, pode-se dizer que as correntes são responsáveis pela distribuição de calor nos oceanos e como uma consequência em todo o planeta.
Durante a alteração do seu estado físico a água absorve calor, armazenando energia solar na molécula de vapor de água à medida que sobe à atmosfera. O vapor de água é transportado pela circulação atmosférica e condensa-se após percursos muito variáveis. Essa água poderá regressar à superfície terrestre numa das formas de precipitação (chuva, granizo ou neve), pela ação da gravidade, ou voltar à atmosfera mesmo antes de alcançar a superfície terrestre (evaporar-se). Em algumas situações poderá ainda transformar-se em neve e cair sobre uma montanha permanecendo por lá muito tempo. Nos continentes, nos locais onde a precipitação é mais elevada, existem florestas e onde a precipitação é mais baixa, existem desertos. A água condensada uma vez na superfície, circula através de “linhas” que se reúnem em rios até atingir os oceanos (escoamento superficial) ou pode se infiltrar nos solos. A maior parte que cai no solo é lixiviada por meio das camadas permeáveis de rocha e é armazenada em aquíferos, que são reservatórios de água. Nesse caso tem-se o escoamento subterrâneo. Os poços escavados até os aquíferos suprem uma parte substancial da água destinada ao consumo humano.
Aquíferos - parte da água da chuva que escoa pelo processo de escoamento artificial é levada para as águas superficiais e para os aquíferos, que correspondem a formações geológicas capazes de armazenar água subterrânea. Neles a hidrosfera entra em contato direto com a litosfera. Uma parte dessa água supre a necessidade de água destinada ao consumo humano.
Existem, no entanto, problemas específicos relacionados aos aquíferos. Um desses consiste no uso excessivo da água caracterizado pela extração intensa frente ao abastecimento das águas superficiais. Em alguns casos, o uso abusivo dos aquíferos, pode resultar em outros problemas, como a perda de pressão do fluido pode levar a subsidência dos solos sobrejacentes. Sumidouros podem aparecer repentinamente, quando grutas de calcário subjacentes desmoronam após dali se extrair água.
Nas áreas litorâneas, os aquíferos entram em contato com os oceanos. O fluxo da água doce bloqueia a passagem da água salgada, mas quando a água doce é bombeada até se esgotar, a água salgada pode invadir e contaminar os poços.
O ciclo hidrológico atua também como um agente modelador da crosta terrestre. Esse processo ocorre devido à erosão da superfície e ao transporte e deposição de sedimentos por via hidráulica, condicionando a cobertura vegetal e, de modo mais genérico, toda a vida na terra.
Os processos relacionados a esse ciclo ocorrem de forma natural há milhares de anos, garantindo a distribuição da água por todo o globo. Embora possa parecer um mecanismo contínuo, com a água se movendo de uma forma permanente e com uma taxa constante, é na realidade bastante heterogêneo, pois o movimento da água em cada uma das fases do ciclo é feito de um modo bastante aleatório, variando tanto no espaço como no tempo. Em alguns casos, a natureza “trabalha” em excesso, provocando chuvas torrenciais que ultrapassam a capacidade dos cursos d'água, quando ocorrem as inundações. Em outras ocasiões, parece que todo o mecanismo do ciclo parou completamente e também a precipitação e o escoamento superficial. A quantidade de água e a velocidade com que ela circula nas diferentes fases do ciclo hidrológico são influenciadas por diversos fatores como: a cobertura vegetal, a altitude, a topografia, a temperatura, o tipo de solo e a geologia. Existe ainda o fato de que o ciclo hidrológico vem sendo alterado de forma muito mais rápida pela ação do homem. Ou seja, a construção de barragens, usinas hidrelétricas e a poluição da água afetam e muito o ciclo hidrológico do planeta causando transformações que podem ser prejudiciais. No caso de usinas hidrelétricas muito grandes, a alteração se dá pela quantidade de água que evapora na região onde se encontra o reservatório. O processo de evaporação mais intenso no local pode alterar sua temperatura e umidade, alterando consequentemente as correntes atmosféricas que passam por ele e o microclima da região. Nesse caso, a construção de pequenas centrais hidrelétricas pode atuar de forma menos impactante.
De forma geral, o ciclo hidrológico conseguiria recuperar a qualidade da água por si só, no entanto, a quantidade de poluentes jogada na água é tão grande que isso não é mais possível, provocando com isso, o transporte de poluentes pelas chuvas. Outro problema generalizado é a contaminação da água dos poços pelo solo circundante. Os solos possuem grande capacidade de absorver contaminantes e podem servir como filtros eficazes, entretanto quando essa capacidade é ultrapassada, os contaminantes penetram os aquíferos.
3.3 Água: propriedades físicas e implicações no clima
As moléculas de água estão fortemente associadas devido às interações dipolo-dipolo e também à estrutura angular de sua molécula. Por isso, a água pode formar uma rede tridimensional de ligações de hidrogênio que conferem essas características físicas peculiares. A água apresenta um elevado calor específico (significa que é necessário fornecer uma quantidade de energia na forma de calor (1 cal) para elevar a temperatura de 1 g de água em 1 oC. Dessa forma, tem-se que a energia consumida para aumentar a movimentação das moléculas de água é inicialmente absorvida para quebrar as “ligações de hidrogênio” e portanto, a água absorve energia sem aumentar sua temperatura drasticamente.
O elevado calor específico da água reflete diretamente no clima e na vida de nosso planeta. Explicitando melhor este fato, tem-se que devido a esta característica, o oceano retém cerca de 1100 vezes mais calor do que a atmosfera. Por isso, durante o verão o calor é estocado nos oceanos e durante o inverno, parte desse calor é transferida de volta para a atmosfera amenizando assim, a temperatura do ar. Baseado na compreensão do significado do calor específico da água associado ao grande volume presente nos oceanos, pode-se perceber porque o oceano age como um moderador climático, diminuindo a amplitude de variação de temperatura entre as estações do ano, transferindo calor das regiões tropicais para as subtropicais e polares por meio das correntes marítimas.
O calor latente de fusão (que por definição é a quantidade de calor necessária para transformar 1 g de uma substância do estado sólido para líquido) e o calor latente de vaporização (transição do estado líquido para gasoso) são outras propriedades físicas que explicam a importância do oceano no clima global. Assim, devido ao elevado calor latente de fusão ocorre um efeito termostático no ponto de congelamento, ou seja, é preciso uma grande quantidade de energia (emitida ou absorvida) para que ocorra uma mudança de estado físico. Ainda, a presença de sais na água diminui seu ponto de congelamento (-1,9 oC), e assim a água do mar não atinge temperaturas inferiores a esse valor. Além disso, devido ao elevado calor latente de vaporização, quando as moléculas passam do estado líquido para o gasoso, elas “carregam” grandes quantidades de energia na forma de calor. Dessa forma, quando ocorre a transição, há transferência de calor para a atmosfera. Quando na atmosfera, o vapor d'água é transportado para outras regiões do planeta e se condensa na forma de chuva liberando este calor latente, ocorrendo a distribuição de calor e a estabilização do sistema climático global.
3.4 Desenvolvendo e aplicando o conhecimento
1. Pesquise sobre as questões mais relevantes para a gestão de recursos hídricos no Brasil e em seu estado.
2. Defina ciclo hidrológico.
3. Defina hidrosfera.
4. Qual a importância dos oceanos para o clima?
5. Quais os principais usos da água potável?
6. Quais as principais formas de poluição da água nos dias de hoje?
3.5 Água: Solvente e Meio Biológico
A água é considerada um solvente universal, já que suas propriedades moleculares permitem que ela dissolva uma grande quantidade de materiais. Em outro aspecto, abriga ecossistemas, ou seja, um grande percentual da biosfera habita o meio aquático. Nesse aspecto, os processos biológicos dos ambientes aquáticos normalmente desempenham um papel crucial em remover substâncias dissolvidas das águas, e esses materiais dissolvidos sustentam a vida.
Os dois fatos podem ser observados seguindo o curso da água através de seu ciclo hidrológico. Da atmosfera ao solo, um dos aspectos que mais predomina é sua atuação como solvente. Dessa forma, pode-se dizer que a água é quase pura quando penetra a atmosfera, mas imediatamente começa a interagir e, com isso, formam-se as chamadas soluções. A água atmosférica está em equilíbrio com outros componentes, principalmente o dióxido de carbono, seja nas nuvens ou na chuva.
Quando a água da chuva incide sobre a terra, o número de interações aumenta conforme essa penetra no solo, em que um número cada vez maior de íons é absorvido. Finalmente, a água e sua carga de materiais dissolvidos se acumulam nas águas superficiais e nos oceanos. Nesse ponto, a função da água como solvente é intensificada por seu papel como ecossistema. Quando se trata de biosfera aquática, o potencial redox, determinado em grande parte pela quantidade de oxigênio dissolvido na água em relação aos nutrientes necessários à vida, é considerado um ponto importante.
3.6 Águas naturais e reações
Quando considerados exclusivamente os processos naturais, os principais constituintes presentes nas águas são produto do intemperismo de rochas que resultam de processos físicos e químicos. O intemperismo físico está associado à fragmentação das rochas, já o intemperismo químico envolve processos de alteração mineral por meio de reações de hidratação/hidrólise, dissolução, precipitação, oxirredução e complexação. A composição física e química das águas subterrâneas refletirá a mobilidade e a solubilidade dos elementos envolvidos no processo de intemperismo. As características naturais das águas também podem ser alteradas em função das reações de oxirredução, que movimentam a vida e as reações ácido-base, que serão aqui tratadas. No caso das reações de oxirredução, uma ênfase sobre os principais agentes oxidantes e a forma como atuam será abordada. Para as reações ácido-base, os principais sistemas serão discutidos.
3.6.1. A água e a litosfera
A química ácido-base de sistemas naturais
Em muitos sistemas, a reação ácido-base é dominada pela interação de íon carbonato (CO32-) (base) com o ácido carbônico (H2CO3). O íon bicarbonato HCO3- , também presente no equilíbrio, é formado pela perda de um hidrogênio do ácido. Os seguintes equilíbrios existem na natureza:
H2CO3(aq) ⇌ H+(aq) + HCO3-(aq)
equação 3.1A primeira constante de dissociação do ácido é numericamente maior que a segunda, que produz o íon carbonato:
HCO3-(aq) ⇌ H+(aq) + CO32-(aq)
equação 3.2O diagrama de espécies para o sistema CO2 - bicarbonato - carbonato em águas naturais mostra a forma dominante para cada uma dessas espécies dependendo do pH.
Por meio da análise do diagrama apresentado na Figura 3.3 é possível perceber que o ácido carbônico é a espécie dominante em pH < 5,0, carbonato predomina em pH > 12,0 e entre os valores de pH de 7,0 a 10,0 o bicarbonato está presente em maior quantidade, embora as outras espécies possam coexistir. Em pH 5,6, correspondente ao pH de água de chuva, a maioria do carbono dissolvido existe como ácido carbônico, porém uma fração considerável corresponde a íon bicarbonato.
Em águas naturais, o ácido carbônico resulta da dissolução do dióxido de carbono (gás) proveniente do ar ou então proveniente da decomposição da matéria orgânica em água. O gás na atmosfera e o ácido na água em contato com a superfície estão em equilíbrio. Na prática, o CO2 existe como gás dissolvido, mas convencionalmente utiliza-se preferencialmente a notação de H2CO3, considerando as duas formas juntas:
CO2(aq) + H2O(l) ⇌ H2CO3(aq)
equação 3.3Outra fonte de íons carbonato da natureza é proveniente do carbonato de cálcio (CaCO3) que se dissolve parcialmente em água. A dissolução de um composto em água ocorre apenas quando as forças de interação íon-água são superadas pelas forças de interação que mantém os íons unidos em um retículo cristalino. Geralmente, as energias que estabilizam o retículo são máximas, quando os íons positivos e negativos envolvidos possuem igual tamanho ou carga. Alguns compostos iônicos são parcialmente solúveis em água. Contudo, se um dos íons do sal moderadamente solúvel agir como um ácido ou uma base, a solubilidade aumenta, porque o íon é parcialmente convertido em ácido ou base. Essa condição vale para vários compostos, porém vamos exemplificá-la para o carbonato de cálcio:
CaCO3(s) ⇌ Ca2+(aq) + CO32-(aq)
equação 3.4Águas naturais que são expostas às rochas calcárias são as chamadas águas calcárias. O íon carbonato dissolvido age como uma base, produzindo íon bicarbonato e íon hidróxido na água:
CO32-(aq) + H2O(l) ⇌ HCO3-(aq) + OH-(aq)
equação 3.5As reações que ocorrem no sistema natural (água, ar e rochas) estão resumidamente representadas na figura.
A Figura 3.4 apresenta um corpo de água, no qual vários equilíbrios com as espécies contendo carbono são exemplificados. Em um primeiro equilíbrio, tem-se o corpo d'água em contato com carbonato de cálcio sólido. Dessa forma, a constante de equilíbrio que relaciona a dissolução de sais em água é dada por:
Kps = [Ca2+] [CO32-]
A solubilidade poderia ser dada somente pelo uso do Kps e admitindo que as concentrações dos íons sejam iguais, sob determinadas condições. Os íons carbonato, agora solúveis agem, em água, e atuam como uma base:
CO32- + H2O ⇌ OH-(aq) + HCO3-(aq)
equação 3.6cuja constante de equilíbrio é expressa por:
Kb = [HCO3-] [OH-]/[CO32-]
O equilíbrio dessa reação desloca-se para a direita em soluções que não sejam muito alcalinas. As equações 3.5 e 3.6 juntas fornecem o seguinte equilíbrio:
CaCO3(s) + H2O(l) ⇌ Ca2+(aq) + HCO3-(aq) + OH-(aq)
equação 3.7Dessa forma, a dissolução de carbonato de cálcio em água pode resultar na produção de íons Ca2+, bicarbonato e hidróxido. As quantidades de íons solúveis dependem dos equilíbrios envolvidos.
Existe ainda a possibilidade de ocorrerem outros equilíbrios, uma vez que existem outras espécies de carbono presentes na água. Dessa forma, outros equilíbrios podem ser destacados:
CO2(aq) + H2O(l) ⇌ H2CO3(aq)
equação 3.8e ainda:
H2CO3(aq) ⇌ H+(aq) + HCO3-(aq)
equação 3.9HCO3-(aq) ⇌ H+(aq) + CO32-(aq)
equação 3.10e ainda, tem-se o equilíbrio iônico da água:
H+(aq) + OH-(aq) ⇌ H2O-(l)
equação 3.11Se todos os equilíbrios forem considerados, tem-se ao final do processo a equação 3.12, depois de se cancelar os termos em comum:
CaCO3(s) + CO2(aq) + H2O(l) ⇌ Ca2+(aq) + 2HCO3-(aq)
equação 3.12Então, combinando as quantidades equimolares de carbonato de cálcio sólido e dióxido de carbono atmosférico produz-se bicarbonato de cálcio aquoso, sem qualquer aparente produção ou consumo de acidez ou alcalinidade. Assim, as águas naturais, nas quais ocorre este processo global podem ser “vistas” como o local de uma titulação de um ácido a partir do CO2 do ar com uma base que se origina dos íons carbonato das rochas. As reações formam um equilíbrio bastante complexo.
3.6.2. Sequestro de Carbono
Os maiores estoques de carbono não são encontrados na atmosfera, mas sim, nos ecossistemas marinho e terrestre. Os oceanos correspondem ao maior reservatório de carbono natural, sequestrando naturalmente o carbono de duas formas: por meio de processo físico (circulação termohalina) e pelo processo biológico.
No ecossistema terrestre, o CO2 pode ser fixado tanto no solo, quanto na floresta. A quantidade de CO2 que é armazenada corresponde a um balanço entre a absorção pela planta, fixação de carbono no solo e as perdas por respiração e decomposição. Muitos desses processos são baseados na fotossíntese, ou seja, as plantas absorvem CO2 e o armazenam como açúcar, amido e celulose. Esse carbono pode ser liberado continuamente dependendo da planta e da fase da vida. Além disso, um processo de queimada pode liberar rapidamente todo o carbono absorvido pela atmosfera.
O conceito de sequestro de carbono foi consagrado pela Conferência de Quioto, em 1997, com a finalidade de conter e reverter o acúmulo de CO2 na atmosfera. Para mitigar o aquecimento global, uma variedade de meios artificiais de captura e de sequestro do carbono, assim como processos naturais estão sendo estudados e explorados. Dentre os ecossistemas que podem ser estudados para mediar este problema estão os terrestres e os oceânicos.
O sequestro de carbono direto ou sequestro artificial ou geológico de carbono, resulta da separação e captura do CO2 gerados em processos industriais e em processos relacionados à geração e/ou consumo de energia, seguido de transporte para um local de estocagem segura, de modo que ocorra o isolamento do gás por um longo período de tempo. Uma das alternativas idealizadas para o sequestro artificial de carbono consiste em acelerar o processo natural de captura de CO2 da atmosfera, reduzindo assim o efeito estufa. Em dias atuais não se pode estimar o quanto de carbono pode ser sequestrado sem ocasionar problemas para a estrutura e a função do ecossistema marinho. Porém, pesquisas realizadas com bastante cuidado tentam avaliar os riscos em potencial, bem como os benefícios do sequestro de carbono, além dos custos associados a esses. Dois diferentes métodos podem ser usados para isso, sendo um destes a injeção direta - em que CO2 é injetado no fundo do oceano (se isto acontecer a grandes profundidades formar-se-á um lago). O pH da água torna-se ácido se CO2 for dissolvido na água. O aumento da acidez reduz a quantidade de carbonato de cálcio na água, afetando o crescimento e as taxas de reprodução de alguns animais marinhos como peixes e plânctons. Para grandes profundidades, a capacidade de eliminar gás carbônico é reduzida, levando à morte de organismos por asfixia. Essa baixa capacidade de eliminar gás carbônico pode levar também a uma fertilização do oceano, que será posteriormente explicada.
Outra alternativa é a reação do CO2 com minerais básicos. Por exemplo, se o calcário fosse usado como reagente, o bicarbonato seria o produto final. Esse produto poderia ser disposto em longo prazo na forma líquida, provavelmente no fundo do oceano. A carbonatação mineral é uma alternativa, mas ainda não se sabe se a injeção direta de CO2 nos oceanos ou nos aquíferos profundos é uma alternativa viável, uma vez que os gases podem vazar com o tempo, já a carbonatação mineral apresenta como inconveniente o fato de apresentar custos maiores.
3.6.3. Química da água e as reações de oxirredução
Oxigênio dissolvido
O oxigênio molecular que está dissolvido nas águas naturais é um importante agente oxidante (substância que extrai elétrons de outras espécies). As reações permitem que o oxigênio que em princípio tem estado de oxidação zero passe para o estado de oxidação -2. A seguir, são apresentadas as representações das meias-reações, em meio básico e em meio ácido.
Em meio ácido: O2(aq) + 4H+(aq) + 4e- → 2H2O(l)
equação 3.13Em solução básica: O2(aq) +2H2O(l) + 4e- → 4OH-
equação 3.14A concentração de oxigênio dissolvida em água é pequena e dependente da temperatura. Tem-se um valor correspondente a 8,7 mg L-1 a 25 °C). A constante de equilíbrio que governa a quantidade de O2 dissolvido em equilíbrio com o estado gasoso corresponde à constante da Lei de Henry, KH que tem um valor de 1,3 x 10-3 mol L-1 atm-1 a 25 °C. A solubilidade dos gases aumenta conforme ocorre a diminuição da temperatura e diminui no caso de um aumento de temperatura.
A água que é aerada através dos cursos de água e rios é reabastecida de oxigênio de forma constante. A quantidade de oxigênio em águas naturais, no entanto, sofre variações dependendo da sua profundidade. Quando se tem abundância de oxigênio na água, o que caracteriza um máximo de potencial redox, tem-se o que chamamos de condição aeróbia. A matéria orgânica de origem biológica, como a encontrada em plantas mortas e restos de animais, é comumente oxidada pelo oxigênio. Há também o fato de que o oxigênio dissolvido em água é consumido pela oxidação da amônia dissolvida, NH3 e também íons NH4+. Essas espécies estão presentes na água como resultado de uma atividade biológica e são oxidadas eventualmente para íons nitrato.
A demanda bioquímica de oxigênio (DBO) é a quantidade de oxigênio necessária para oxidar a matéria orgânica biodegradável presente na água e é expressa em miligramas de O2 necessário para realizar a oxidação do carbono orgânico em 1 litro de água. Já a demanda química de oxigênio (DQO) é um parâmetro que mede a quantidade de matéria orgânica a ser oxidada pela adição de um agente oxidante (dicromato de potássio em meio de ácido sulfúrico), expressa em termos de mg de O2 por litro de amostra. O valor obtido é sempre superior à demanda biológica de oxigênio já que se oxidam por esse método também algumas substâncias não biodegradáveis. A demanda química de oxigênio é um parâmetro indispensável aos estudos visando à caracterização de efluentes e visa observar a possível biodegradabilidade de efluentes domésticos e industriais.
Finalmente, observamos que há duas outras formas de medir a quantidade de substâncias orgânicas presentes em águas naturais. A concentração de carbono orgânico total (COT) usada para caracterizar a matéria orgânica dissolvida e suspensa em águas naturais e o carbono orgânico dissolvido (COD) usado para caracterizar somente o material orgânico que está dissolvido.
As condições aeróbias (presença de oxigênio) e anaeróbias (deficiência de oxigênio) podem ser encontradas em diferentes partes de um mesmo lago. Essas condições são encontradas de forma mais comum no verão, quando a estratificação estável de distintas camadas ocorre. Nesse caso, a superfície da camada d'água, chamada epilímnio, normalmente contém um nível de saturação de oxigênio dissolvido, em virtude do contato com o ar e com o O2 produzido durante a fotossíntese de algas. No entanto, próximo ao fundo do lago que é chamado de hipolímnio, a água tem deficiência de oxigênio porque não se tem contato com o ar, e o O2 é consumido quando o material biológico, como algas mortas que afundam para estas profundidades, se decompõem. Quando não se tem oxigênio presente na água, os organismos que dependem da respiração aeróbia não sobrevivem e nesse caso, as bactérias anaeróbias passam a dominar. Essas condições, no entanto, podem ser alteradas no decorrer do ano devido à mudança de estações. A seguir, será discutida mais detalhadamente a importância de outros agentes oxidantes que não o oxigênio.
3.6.4. Outros tipos de compostos oxidantes
Compostos de nitrogênio em água naturais
Existem várias formas ambientalmente importantes de nitrogênio, tanto orgânicas quanto inorgânicas, que diferem na extensão da oxidação do átomo de nitrogênio. Os estados de oxidação podem variar: em processos em que catalisados por micro-organismos de nitrificação, amônia e íons amônio (estado de oxidação -3) são oxidados para nitrato (estado de oxidação +5), enquanto que nos processos de desnitrificação correspondente, nitrato e nitrito são reduzidos para nitrogênio molecular. Quando não existe oxigênio no meio, o nitrato disponível é considerado o oxidante mais eficaz. Nesse caso, as bactérias com ação desnitrificadora consomem nitrato e liberam N2 (estado de oxidação 0), um outro subproduto é o N2O ( estado de oxidação +1), um gás do efeito estufa. Ambos os processos são importantes em solos e em águas naturais, conforme colocado detalhadamente no ciclo do nitrogênio.
Compostos de ferro e manganês em águas naturais
Outros compostos importantes em reações de oxirredução são os compostos de metais como o ferro e o manganês. São principalmente importantes quando os nitratos estão em baixa concentração e atuam da seguinte forma: uma fonte de oxidantes para a oxidação microbial e, de outra forma, são capazes de se ligar a metais tóxicos pesados, compostos orgânicos deletérios e gases. Quando esses metais são reduzidos, perdem a capacidade ligante, por se tornarem solúveis e assim podem liberar os materiais tóxicos.
Compostos de enxofre em águas naturais
Os compostos de enxofre podem ser encontrados em diferentes estados de oxidação. Os estados mais comuns de oxidação inorgânica variam de altamente reduzido (-2) no gás de sulfeto de hidrogênio e minerais insolúveis contendo íon sulfeto, para o estado de oxidação mais alto, como no H2SO4 e sais contendo o íon sulfato (SO42-). Em moléculas inorgânicas e bioinorgânica tais como aminoácidos, níveis intermediários de enxofre estão presentes. Quando tais substâncias se decompõem anaerobicamente, sulfeto de hidrogênio, H2S, e outros gases contendo enxofre em formas altamente reduzidas — tais como CH3SH e CH3SCH3 são liberadas, dando ao pântano seu odor desagradável.
3.6.5. Os íons presentes em águas naturais e potáveis.
Íons em água doce
Em amostras de águas calcárias não poluídas, os íons mais abundantes encontrados são: cálcio e o bicarbonato. Em menor extensão encontram-se os íons magnésio, sulfato, cloreto, sódio, fluoreto e potássio. Vale ressaltar que os íons bicarbonato podem estar também presentes em águas doces devido ao intemperismo de aluminosilicatos (o intemperismo do aluminossilicato libera Na+ ou K+ na água) em rochas e solos na presença de dióxido de carbono atmosférico. Tem-se o seguinte equilíbrio para a reação de intemperismo, em termos gerais, em que M corresponde a um metal.
M+(Al-silicatos-)(s) + CO2(g) + H2O(l) → M+(aq) + HCO3-(aq) + H4SiO4(aq)
equação 3.15Os íons fluoreto F- possuem enorme variação dependendo da região do mundo. A maior fonte de F- é proveniente do mineral fluorapatita, Ca5(PO4)3F. O íon fluoreto é importante para a fortificação dos dentes e assim é frequentemente adicionado à água. Uma quantidade limite deve ser adicionada, uma vez que altas concentrações de íons F- causam manchas nos dentes. A adição de íons fluoreto em água tratada é motivo de controvérsias porque há relatos de que a alta concentração de fluoreto pode ser perigosa, sendo considerada, muitas vezes, carcinogênica.
Em águas naturais, a concentração de alumínio é de cerca de 10-6 mol L-1 e isso decorre do fato de que na faixa típica de pH para águas naturais (6 a 9), a solubilidade do alumínio contido em rochas e solos para os quais essa água está exposta é muito pequena. Esta solubilidade, em água, é controlada pelo hidróxido de alumínio, Al(OH)3 e aumenta conforme diminui-se o pH. Assim, o alumínio é muito mais solúvel em rios altamente acidificados e lagos em que o valor de pH não fica abaixo de 6 ou 7. Enfim, o alumínio é normalmente o cátion principal em águas em que o pH é menor que 4 ou 5, excedendo ainda as concentrações de Ca e Mg que são dominantes para valores de pH maiores.
Pesquisas tentam relacionar doenças neurológicas com a alta concentração de alumínio, mas não existem ainda dados conclusivos. Outros problemas estão relacionados à grande solubilização desses íons em água, que poderia causar matança de peixes, dentre outros problemas.
Íons abundantes em água do mar
Os íons presentes em água do mar apresentam-se em maiores concentrações do que em água doce, porque nessa há grandes quantidades de sais dissolvidos. As espécies predominantes na água do mar são sódio e cloreto, podendo conter em quantidades menores os íons cálcio, magnésio e sulfato e ainda menores quantidades de outros íons. Se a água marinha evapora, os seguintes sais são precipitados na ordem: CaCO3, CaSO4∙H2O, NaCl, MgCl2, NaBr e por fim KCl. Portanto, a água do mar é a soma de todos os sais. Em virtude do equilíbrio, CO2- bicarbonato - carbonato, o pH médio de águas superficiais oceânicas é 8,1. A água do mar tem um baixo conteúdo de carbono, sendo seu DOC de cerca de 1 mg L-1.
As principais fontes de elementos como o cálcio e o magnésio, responsáveis pela dureza da água, provêm das rochas calcárias ou calcário dolomítico e de depósitos de sulfato de (gipsitas). Esses íons são provenientes de reações de neutralização dos compostos que por fim liberam os cátions (Ca e Mg) para uma solução aquosa em quantidades consideráveis. Outras fontes de íons que podem causar dureza são ferro e estrôncio. Apesar disso, a dureza é expressa em termos de mol L-1 ou ppm de CaCO3. Em termos práticos, tem-se que uma água com dureza acima de 500 ppm está em condições impróprias para inúmeros processos industriais.
A determinação da dureza da água pode ser realizada por meio de uma análise volumétrica, num processo mais conhecido como titulação complexométrica ou complexometria. A descrição do método está fora do escopo deste livro, mas de uma forma geral pode-se dizer que os íons Ca2+ e Mg2+ em solução formam um complexo vermelho com o corante negro de eriocromo T, e à medida que se vai adicionando a solução de ácido etilenodiaminotetracético (EDTA) ocorre a formação de um novo complexo, agora do EDTA com íons cálcio ou magnésio, separando-os do corante. Quando a quantidade de EDTA adicionada for suficiente para complexar todo o cálcio e/ou magnésio, a solução torna-se azul, indicando o final da análise volumétrica, que por meio de cálculos volumétricos pode indicar a concentração destes íons.
O índice de alcalinidade é um parâmetro que mede a real concentração de ânions básicos em água. Em termos práticos, a alcalinidade de um corpo aquático corresponde à medida da capacidade do corpo aquático em resistir à acidificação pela neutralização, quando submetida, por exemplo, a uma chuva ácida. Por definição é o número de mols de H+ necessário para titular 1 litro de amostra de água até o ponto final. Nos casos em que íons como bicarbonato, carbonato, bem como OH- e H+ estão presentes, tem-se para a alcalinidade total:
Alcalinidade total = 2[CO32-] + [HCO3-] + [OH-] − [H+]
equação 3.16Outras fontes de alcalinidade podem incluir os íons amônia, assim como ânions como os de ácido fosfórico, bórico, silícico e sulfídrico. Nessa classe, também se inclui a matéria orgânica de origem natural. A alcalinidade é determinada segundo a análise volumétrica e os valores de alcalinidade são algumas vezes expressos como miligramas de equivalentes de CaCO3, mais do que H+ por litro, de maneira similar ao índice de dureza.
3.6.6. Interação da água com o solo e a química dominante
Uma grande quantidade de CO2 está presente no solo devido à decomposição bacteriana. Em outro aspecto, as plantas exsudam ácidos no solo e isso faz com que a água da chuva em contato com o solo tenha seu valor de pH diminuído para um valor de 5,0, considerando que o pH da água da chuva tenha inicialmente um valor de 5,7 por causa da dissociação de CO2 atmosférico. À medida que esta água vai penetrando no solo a profundidades um pouco maiores têm-se o início das reações de neutralização pelos minerais presentes no solo. Esses minerais são representados, muitas vezes, por calcário e na sua ausência ocorre a neutralização por meio de troca iônica, ou seja, troca de prótons pelos cátions da base nos locais de troca iônica de partículas de argila e húmus. O número de partículas intercambiáveis (entre os espaçamentos basais nos planos cristalinos dos minerais) é chamado de capacidade de troca iônica. Como os sítios de troca iônica estão na superfície da partícula, a capacidade de troca iônica é bem menor que a capacidade de neutralização de solos calcários. Os processos correspondentes a essas reações podem ser assim esquematizados, conforme mostrados na Figura 3.5:
O solo pode ainda ter contato com outros tipos de contribuições provenientes da atmosfera, como fontes de SO2 e NO originadas tanto por fontes naturais quanto antropogênicas. Essas substâncias são removidas do ar em poucos dias por reações de oxidação e posteriormente transferidas para o solo de duas maneiras principais: deposição seca em aerossóis e indiretamente por via úmida pela chuva. A chuva ácida provoca inúmeros problemas ambientais, conforme relatado em diversos estudos. Dentre estes, estão relacionados os prejuízos com a vegetação e a acidificação de lagos que provoca a morte de peixes. Além disso, as concentrações de cálcio e magnésio no solo são reduzidas pela ação da chuva ácida, devido à lixiviação.
Os danos causados pela acidificação se intensificam quando os solos também são poluídos por metais tóxicos, como cádmio, cobre, chumbo e zinco. Esses, sendo cátions competem com o hidrogênio e os cátions da base por locais de troca iônica, devido à substituição de íons metálicos na estrutura dos minerais de argila silicatada. As cargas não compensadas são equilibradas com cátions móveis, que dão aos minerais de argila silicatados o caráter de agente de troca de cátions. Em alto pH, os íons metálicos em solos bem tamponados são geralmente retidos nos locais de troca, e suas concentrações na solução do solo é baixa. Quando ocorre uma diminuição no valor de pH, a quantidade de metais na solução do solo aumenta, podendo ser lixiviados e contaminar a vegetação ou aquíferos. Uma bacia hidrográfica pode ter seu pH diminuído pelo aumento contínuo de despejo de ácido neste meio. O tempo em que isso ocorre é muito variável e depende de inúmeros fatores, como: velocidade de deposição, natureza do solo, tamanho da bacia hidrográfica e as características de vazão de lagos e aquíferos.
3.6.7. A importância das reações químicas considerando que água é um meio ecológico
Produtores primários são os vegetais autótrofos, ou seja, aqueles que produzem seu próprio alimento por meio da fixação de carbono (dióxido de carbono) no processo de fotossíntese. Dessa forma, eles dependem ainda da luz solar e, portanto, estão limitados à região próxima da superfície. Na água, os produtores primários correspondem às cianobactérias, fitoplâncton e algas. A atividade biológica ocorre na zona eufótica (corpo d'água que recebe radiação para que ocorra fotossíntese) em que os produtores primários são consumidos pelos animais ou decompostos pelas bactérias, em um ciclo contínuo de fotossíntese e respiração. No entanto, alguns organismos mortos caem para baixo na zona eufótica, por causa da gravidade e sua degradação continua em função da decomposição bacteriana. Em determinados períodos, como existe a estratificação térmica há pouca mistura entre a camada superficial mais quente e a camada mais profunda, mas fria. Dessa forma, o que ocorre é a transferência de carbono e nutrientes da superfície para as camadas mais profundas e para os sedimentos (bomba biológica).
De modo geral, pode-se dizer que a bomba biológica é responsável pelo aumento na concentração de carbonato nas águas profundas, contribuindo para o ciclo global do carbono. Caso isso não ocorresse, o nível de CO2 atmosférico duplicaria na ausência da bomba biológica.
Eutrofização de águas doces
A produtividade biológica varia como um ciclo. O início do inverno reduz o aquecimento solar da superfície das águas e assim desaparece a estratificação térmica, tornando a densidade da água uniforme, o que permite que os nutrientes sejam trazidos para a superfície. Apesar do suprimento de nutrientes ser alto no inverno, a produtividade é inibida pelas baixas temperaturas e pelos níveis de luz. A primavera traz a luz solar e o calor, provocando a florescência de outras plantas aquáticas. À medida que o crescimento das plantas se intensifica o suprimento dos nutrientes se reduz e a atividade do fitoplâncton cai. A matéria das plantas mortas é decomposta pelas bactérias, o suprimento de nutrientes aumenta novamente e um segundo pico de atividade de fitoplâncton é observado no outono. O suprimento de nutrientes é limitado em águas não poluídas, a DBO nas águas superficiais raramente supera a disponibilidade de oxigênio. Isto pode ser interrompido, somente se uma carga excessiva de nutrientes for adicionada ao meio, provenientes de efluentes ou do escoamento superficial de origem agrícola (fontes de origem antrópica). Os nutrientes adicionados sustentam uma população maior de fitoplâncton, produzindo as chamadas “florescências algais”. Quando algas morrem, a decomposição pode consumir todo o suprimento de oxigênio, matando peixes e outras formas de vida. Quando o oxigênio acaba, a população de micro-organismos que começa a predominar são os organismos anaeróbios que produzem amônia, metano e ácido sulfídrico, a esse processo chamamos eutrofização. Com o passar do tempo, um lago inicialmente claro aos poucos se eutrofiza, enchendo-se de sedimento até transformar-se num pântano e por fim em terra seca, num processo que geralmente leva milhares de anos (ciclo natural), mas que pode ser acelerado por uma fertilização excessiva da água.
Elementos nutrientes
O processo de eutrofização natural é consequência da dinâmica dos nutrientes em um ecossistema aquático. Desse modo, os nutrientes são assimilados do meio ambiente pelos produtores primários que servem de alimentos para os produtores secundários, incluindo os peixes. Após a decomposição, as plantas e os tecidos mortos são decompostos pelas bactérias que restauram os nutrientes para a água e os produtores primários crescem de forma controlada pelos nutrientes limítrofes.
Os principais elementos nutrientes são carbono, nitrogênio e fósforo, refletindo a composição média das moléculas nos tecidos biológicos. Vários outros elementos também são necessários como enxofre, silício, cloro, iodo e outros elementos metálicos. O carbono, elemento exigido em maior quantidade, é abundantemente fornecido ao fitoplâncton pelo CO2 atmosférico, já os elementos menores são supridos em níveis adequados pela água.
Na maioria das vezes, o elemento limítrofe é o nitrogênio ou o fósforo. Embora o nitrogênio constitua 80% da atmosfera, esse só é disponibilizado pela ação de bactérias fixadoras de N2 ,que vivem em ação simbiótica com certas plantas.
O fósforo não possui nenhum suprimento atmosférico porque não existem compostos de fósforo gasosos e de ocorrência natural. Em águas superficiais a maior parte do fósforo está contida na biomassa do plâncton e a disponibilidade de fósforo depende da reciclagem da biomassa por bactérias. Parte do fósforo se perde nas águas mais profundas e sedimentos quando os organismos mortos afundam. No inverno, quando as águas são revolvidas, o fósforo nas águas profundas é carregado para a superfície e sustenta a florescência de plâncton na primavera.
Outro nutriente: o Ferro
Embora o nitrogênio e o fósforo correspondam aos nutrientes limítrofes aquáticos próximos da terra, em algumas regiões de mar aberto o ferro é o nutriente que limita a produção biológica. Ou seja, dentre os “metais residuais” essenciais à vida, o ferro é requisitado em maior quantidade. Esse é bastante utilizado em enzimas envolvidas no transporte de elétrons e no processamento de O2 e N2, bem como em sua redução (para N) para produtos de oxidação. Portanto, os micro-organismos precisam de suprimento constante de ferro. Como é abundante na crosta terrestre, a limitação do ferro não constitui problemas para as plantas terrestres ou para os fitoplânctons que crescem próximo a terra. Nos oceanos, contudo, a concentração de ferro é extremamente baixa devido à baixa solubilidade do hidróxido de ferro, na água do mar alcalina. Em muitos casos, na maior parte dos oceanos, o assentamento da poeira proveniente da terra supre os fitoplânctons com ferro suficiente para se desenvolverem, contudo há áreas que são desprovidas de poeira.
A fertilização do oceano poderia provocar efeitos adversos no ecossistema marinho. Devido às grandes taxas de decomposição de fitoplâncton, seriam reduzidos os níveis de oxigênio na água que associada à atividade microbiana podem produzir poluentes gases de efeito estufa, como metano e óxido nitroso.
Desenvolvendo e aplicando o conhecimento
1. Explique como a temperatura afeta a solubilidade do O2 na água. Discorra sobre o conceito de poluição térmica.
2. Defina DBO e DQO. Quais as causas de altos valores de DBO para as águas naturais?
3. O que significam COT e COD e como eles diferem?
4. Elabore um diagrama de forma a classificar as camadas da superfície e do fundo do lago no período do verão, em função de seu caráter oxidante ou redutor. Não esqueça de mostrar as formas estáveis de carbono, enxofre, nitrogênio e ferro nessas duas camadas.
5. Quais os compostos de enxofre reduzidos ou oxidados de importância ambiental?
6. Explique em termos gerais o que significa drenagem ácida de minas.
7. Identifique o ácido e a base que predominam na química de águas naturais. Explique as principais interações sofridas por esses íons.
8. Explique qual a maior fonte entre íons carbonato em águas naturais e registre o nome dado para as águas expostas a essa fonte.
9. Explique os diversos equilíbrios entre CO2 - bicarbonato - carbonato nos diversos meios.
10. Registre a reação aproximada de equilíbrio de íons carbonato e água em um sistema que não está exposto ao dióxido de carbono atmosférico. A reação é ácida, básica ou neutra?
11. Quais as principais fontes de íons em água doce e em água salgada?
12. Defina alcalinidade total e dureza da água.
3.8 Poluição e Purificação da Água
Existem poucas regiões povoadas que não sofrem com algum tipo de poluição das águas, caracterizando-a como um dos maiores problemas mundiais. A discussão sobre a qualidade da água é importante porque implica diretamente na saúde e no bem estar dos seres humanos, assim como na saúde dos ecossistemas aquáticos. Nesse sentido, apresentaremos nesse tópico os principais métodos de tratamento e purificação de águas.
Os processos de purificação variam dependendo do tipo de poluente que pode ser encontrado na água. Para a purificação da água, mesmo antes dos processos de desinfecção vários outros processos são realizados.
3.8.1. Tratamento de águas
Contaminação química e tratamento de efluentes e esgoto doméstico
O esgoto doméstico é o resíduo líquido proveniente das atividades que pode causar sérios problemas tanto ao meio ambiente quanto à saúde das pessoas e deve ser tratado antes de ser lançado no ambiente. A matéria orgânica é um dos principais componentes do esgoto doméstico e se apresenta na forma de pequenas partículas, variando desde tamanhos macroscópicos como: papel, plástico, pano e galhos e que por sua vez podem ser retidos por uma grade, até tamanhos microscópicos, como materiais suspensos na forma de colóides.
No entanto, novos contaminantes estão sendo incorporados no meio ambiente nos últimos tempos. A maioria consiste de medicamentos, em níveis traços que são utilizados pelos seres humanos e outros para fins veterinários. Tem-se aproximadamente 100 tipos de substâncias detectadas no meio aquático, como lagos e águas costeiras. Entre essas, incluem-se estradiol, ibuprofeno, antidepressivos como Prozac® (fluoxetina), antiepilépticos como a carbamazepina, e por vezes produtos de degradação associados aos medicamentos redutores de colesterol.
Atualmente, pesquisas são realizadas para determinar quais os possíveis efeitos colaterais sobre a saúde humana de uma exposição em nível prolongado dos medicamentos provenientes de contaminação de águas. Dentre os medicamentos, os hormônios sintéticos são considerados como os de maior risco potencial para as espécies aquáticas, já que as pesquisas mostram as distorções no desenvolvimento sexual pela exposição a efluentes que contenham a presença de estrógenos. Entretanto, esses medicamentos não são removidos pela utilização dos processos convencionais de tratamento de efluentes e de esgotos.
Existem diversas etapas envolvidas no tratamento de águas. Em uma primeira etapa, o tratamento mecânico (tratamento primário), há a separação das partículas maiores, que incluem a areia e o lodo, que são removidos pela passagem da água por uma grade ao longo de um tanque ou lagoa de decantação. No fundo desse tanque ou da lagoa ocorre a formação do lodo constituído de partículas insolúveis e de aspecto oleoso. O fato de ser oleoso inclui não somente a gordura, óleos ou graxas, mas também os produtos da reação do sabão com íons cálcio e magnésio. Os produtos menos densos do que a água que ficam na superfície são retirados na forma de espuma. Remove-se por volta de 30% da DBO nesta etapa de tratamento, mesmo que neste estágio o processo seja de natureza puramente mecânica.
Após passar pelo tratamento primário, a água torna-se mais clara, mas ainda tem um alto valor de DBO, normalmente de centenas de miligramas por litro – e é imprópria para a manutenção da vida aquática, principalmente para os peixes, se for liberada. Este valor de DBO que é considerado alto deve-se às partículas coloidais de origem orgânica. Em outra etapa de tratamento, o tratamento secundário ou biológico, a matéria orgânica será oxidada de forma biológica por micro-organismos. Em seguida, a água pode ser pulverizada sobre um leito de areia e pedregulho, ou sobre um componente plástico coberto com bactérias aeróbias (filtragem por gotejamento) ou ela pode ser agitada em um reator de aeração (processo de lodo ativado).
As reações de oxidação biológica reduzem a DBO da água poluída para menos de 100 mg L-1, cerca de 10% da concentração original do esgoto não tratado. Outro fato a ser destacado é que o processo de nitrificação pode ocorrer em alguma extensão, neste caso, compostos contendo nitrogênio são convertidos para íons nitrato e dióxido de carbono. Então, durante o tratamento secundário desses efluentes, que ocorre a partir de reações bioquímicas, o material orgânico oxidável que não foi removido na primeira etapa agora o é.
O tratamento terciário do efluente (avançado ou químico) ainda pode ser utilizado, se necessário, e isto ocorre em alguns municípios. Nessa fase, substâncias específicas são removidas melhorando a qualidade da água potável.
Os materiais coloidais remanescentes podem ainda ser removidos usando sal de alumínio, no mesmo processo utilizado para a purificação da água potável. Os metais presentes podem ser removidos pela precipitação, seja como hidróxidos ou sulfetos metálicos.
Os compostos orgânicos dissolvidos e também alguns metais podem ser removidos pela passagem da água contaminada por carvão ativado. Os fosfatos, outro tipo de contaminante, podem ser removidos pela precipitação na forma de sais de cálcio. Deve-se salientar, no entanto, que parte do fosfato foi consumido no tratamento secundário, quando da incorporação pelos micro-organismos que o consumiram na forma de nutrientes.
Os metais presentes também podem ser removidos pela precipitação, seja como hidróxidos ou sulfetos metálicos. Outros metais, como o ferro, podem ser removidos, pela aeração em conjunto com algum oxidante forte e em pH elevado, que permitem a oxidação a Fe3+ que é insolúvel.
Em alguns casos, as águas residuárias podem conter ainda compostos nitrogenados, por exemplo, a amônia. A remoção desses compostos é considerada necessária. Para o caso da amônia, a remoção desta pode ser realizada elevando-se o pH até cerca de 11 (usualmente com cal), que converte o íon amônio a amônia. O borbulhamento de ar pode remover a amônia dissolvida, mas esse é um processo caro porque gasta bastante energia. Outra forma de remover o íon amônio é usando troca-iônica.
O tratamento de efluentes pode ser feito de forma alternativa, por meio do tratamento biológico em um pântano artificial (ou um brejo construído) que contenha plantas como tifas e junco. Bactérias e outros micro-organismos que vivem nas raízes de plantas e rizomas podem ser usados para descontaminar a água. Essas plantas são capazes de absorver metais em suas raízes e concentrar os contaminantes em suas células. Para tratar os esgotos, instalações são construídas e o tratamento primário (para filtrar os sólidos etc.) é normalmente implementado antes do efluente ser bombeado para o tanque, onde o equivalente aos tratamentos secundário e terciário acontece.
Nesse processo, grandes quantidades de lodo não são geradas, em contraste com outros tratamentos convencionais. Esse não requer a adição de outro componente químico sintético e nem o consumo de energia convencional. O problema apresentado por tais instalações é o decaimento da vegetação que deve ser limitada para que a DBO da água não aumente muito mais. Outro problema está no fato de que os pântanos requerem uma grande extensão de terra para serem construídos, sendo uma alternativa, o fato de que uma parte pode ser construída em rota vertical.
Os tanques sépticos são usados para descontaminar esgotos, uma vez que as instalações centrais de tratamento de esgoto não estão disponíveis. Embora os sólidos permaneçam no tanque, as gorduras e os óleos sobem para a superfície e são periodicamente removidos. A bactéria no efluente alimenta o lodo no fundo do tanque, liquefazendo o resíduo. A água parcialmente purificada flui do tanque dentro da drenagem subterrânea, quando a completa descontaminação acontece. O sistema é relativamente passivo, comparando-se às instalações centrais, e como nos tanques artificiais, um tempo é necessário para que o processo ocorra. Além disso, os compostos de nitrogênio são convertidos para nitrato, mas o último não é reduzido para nitrogênio molecular, tanto que a água subterrânea sob o sistema séptico pode tornar-se contaminada pelo nitrato, como discutido anteriormente neste capítulo.
Lodos de esgoto e deposição
Após a decomposição orgânica, o lodo pode ser descartado em aterros ou corpos de água. Esse lodo é, no entanto, rico em nutrientes e pode ser utilizado para fins de fertilização, desde que esteja livre de substâncias tóxicas como os metais pesados, alquilfenóis de detergentes, compostos farmacêuticos e os micro-organismos patogênicos que podem contaminar água, solo e plantas. Em poucas estações de tratamento é feita uma avaliação para eliminar esses materiais antes da disposição final ocorrer.
Processo de desinfecção para a prevenção de doenças
Os contaminantes biológicos constituem as causas mais comuns de doenças. Essas patogenias podem ser disseminadas pela água e estão presentes em todas as partes do mundo. Com base nisso a desinfecção da água visa à eliminação de micro-organismos, como as bactérias do grupo Salmonella e a Escherichia coli, o vírus da poliomielite, o vírus da hepatite A e o vírus Norwalk e os protozoários, como os Crypstosporium e a Giardia lamblia.
O processo de desinfecção pode assumir diferentes formas: uma das formas mais comuns consiste na passagem da água por um leito de areia. Nesse caso, a areia retém os sólidos suspensos de todos os tipos, incluindo micro-organismos, abaixo de 10 µm de diâmetro e alguns compostos químicos, por meio de processo para desinfetar a água.
Em outro processo, alguns contaminantes, tais como pequenas partículas, incluindo os micro-organismos podem ser excluídos pela passagem da água através de uma membrana, em que os poros são de tamanho uniforme e microscópico. Uma membrana ou algumas outras barreiras análogas contendo poros de 0,002 a 10 µm de diâmetro, são utilizadas em processos de microfiltração e ultrafiltração para a remoção de constituintes da água com tamanhos maiores que esses. Neste caso, a água é passada pelas paredes da membrana por pressão ou por sucção. A versão mais moderna desta tecnologia emprega uma membrana composta de milhares de fios de plástico que são entrelaçados e apresentam tamanhos de poros muito finos, mas esses processos (microfiltração e ultrafiltração) obviamente não removem íons dissolvidos ou pequenas moléculas orgânicas.
Outro sistema envolve a osmose reversa, algumas vezes chamada de hiperfiltração. Na osmose reversa, a água é forçada sob alta pressão (o que requer energia e assim encarece o processo) a passar através de uma membrana semipermeável composta por um material polimérico orgânico como o acetato de celulose ou triacetato. De um lado da membrana há a água a ser purificada e do outro lado da membrana há a água pura. A água contaminada é forçada por meio de pressão a passar pelo filtro de membrana para o lado da água pura. Normalmente o processo seria o inverso, uma vez que a tendência seria a água pura passar para o outro lado, diluindo os contaminantes, dessa forma o processo é revertido e por isso chamado de osmose reversa. Por osmose reversa todas as partículas, moléculas e íons com menos de 1 nm de tamanho são removidas. Esse processo é útil para remover íons de metais alcalinos e também metais pesados. Além do gasto de energia, previamente comentado, uma desvantagem da técnica é o desperdício de água, uma vez que grande parte da água é descartada.
As partículas, moléculas (incluindo pequenas moléculas orgânicas) e íons com menos de 1 nm (0,001 μm) de tamanho são removidos por osmose reversa. A osmose reversa é usada em larga escala para a dessalinização e, portanto, é uma técnica empregada em hospitais e em unidades renais para produzir água livre de íons.
Em um último processo, a radiação ultravioleta também pode ser utilizada para a desinfecção de águas. Lâmpadas potentes contendo vapor de mercúrio, cujos átomos excitados emitem radiação em 254 nm são imersos em um fluxo de água. O processo se torna menos eficiente se existe a presença de ferro e substâncias húmicas porque essas absorvem a radiação UV e as tornam menos disponíveis para o processo de desinfecção. Geralmente 10s de irradiação são suficientes para micro-organismos tóxicos, incluindo Crysptosporidium.
A eliminação de bactérias e vírus perigosos em água potável, especialmente aquelas provenientes de matéria fecal de animais e humanos, deve ser feita pela aplicação de oxidantes mais fortes do que o oxigênio, como por exemplo, o ozônio (O3). Pelo fato de que esse não pode ser transportado ou estocado, deve ser gerado no local e para isso é necessária uma descarga elétrica (20.000V) em ar seco. O ar carregado do ozônio produzido é borbulhado através da água por cerca de 10 minutos, sendo esse tempo de contato suficiente para o processo de desinfecção. O tempo de vida das moléculas de ozônio é curto e assim não há proteção residual na água purificada para futuras contaminações.
Alguns contaminantes presentes na água podem reagir com o ozônio, como o bromo, por exemplo, formando compostos orgânicos oxigenados, como formaldeído e outras moléculas de aldeídos de pesos mais baixos, que podem ser tóxicos. Nos casos em que há íons brometo neste ambiente, o ozônio reagirá com ele para produzir íons bromato que são carcinogênicos. Os íons bromato produzidos pela ozonização podem subsequentemente reagir com a matéria orgânica na água para produzir compostos organobromados, também tóxicos. Esses são os chamados subprodutos da desinfecção.
Outro agente oxidante utilizado para estes casos é o dióxido de cloro (ClO2). As moléculas de ClO2 geram radicais livres e oxidam as moléculas orgânicas pela extração de elétrons:
ClO2(g) + 4H+(aq) + 5e
As semirreações de oxidação subsequentemente geram cátions orgânicos que eventualmente reagem e se tornam mais completamente oxidadas.
Assim como o ozônio, o ClO2 é gerado no local da utilização, o que acontece a partir da oxidação de sua forma reduzida, o íon clorito (ClO2-) de sais de clorito de sódio, (NaClO2).
ClO2-(aq) → ClO2(g) + e-
equação 3.18Uma parte do dióxido de cloro formado (ClO2) é convertido a íons clorato (ClO3-). A presença de íons clorito e clorato na água são problemas devido à sua potencial toxicidade.
Dentre todos os agentes oxidantes, o ácido hipocloroso, (HClO), é o agente mais comum porque mata os micro-organismos por meio da passagem rápida por suas membranas celulares. Esse tipo de desinfecção é efetiva e relativamente de custo mais baixo. Um pequeno excesso deste composto em água tratada promove uma desinfecção residual durante a posterior estocagem.
O ácido hipocloroso pode ser gerado, dentre outras formas, de duas maneiras.
Pela reação do cloro molecular com água:
Cl2(g) + H2O(aq) → HClO(aq) + H+(aq) + Cl-(aq)
equação 3.19ou pela reação do hipoclorito de cálcio ou hipoclorito de sódio em água:
OCl-(g) + H2O(aq) → HClO(aq) + OH-(aq)
equação 3.20Uma das desvantagens desse agente de cloração para a desinfecção da água é a produção concomitante de substâncias orgânicas cloradas, algumas das quais tóxicas. Isso porque o HClO não é somente um agente oxidante, mas também um agente de cloração. Exemplos de subprodutos são: ácido acético halogenado, ácido dicloroacético, CHCl2-COOH, um carcinogênico mais potente que o clorofórmio. Há também a produção de halometanos e se a água ainda contiver fenol pode dar origem a fenóis clorados que também são tóxicos.
Atualmente, os órgãos oficiais da saúde expressam preocupação sobre a possível ligação entre a produção de trihalometanos e suas consequências para a saúde humana que podem incluir malformações, natimortos, crescimento anormal do feto e certos defeitos de nascimento. As pesquisas nesta área não são totalmente conclusivas, exigindo a necessidade de mais estudos.
A vantagem sobre outros métodos é que o cloro permanece dissolvido na água depois que essa deixou a planta de tratamento, e dessa forma a água é protegida de subsequente contaminação por bactérias.
3.9 Água subterrânea: contaminação química e remediação
Em termos gerais, tem-se que grande parte da água doce que está disponível no planeta Terra encontra-se na parte subterrânea, e metade dela encontra-se em profundidades que excedem a um quilômetro. A água subterrânea corresponde à água doce que está presente na zona saturada e está em torno de 0,6% do abastecimento total de água do mundo. É proveniente da precipitação que incide sobre a superfície do solo, e uma pequena fração dela é filtrada até a zona saturada. A água subterrânea varia em “idade”, de uns poucos anos até milhões de anos. Como exemplo, em zonas normalmente áridas, muito da água subterrânea que se tem acesso, está lá desde as condições úmidas da última era glacial e não será rapidamente substituída. Na região saturada há o lençol freático, como é comumente chamada a água subterrânea. Quando o lençol freático situa-se sobre o solo, encontramos os lagos e a água corrente. Quando a água subterrânea está contida em um solo composto de rochas porosas, como arenito, ou em rochas altamente fraturadas, como pedregulho ou areia, e se as águas mais profundas estão em contato com uma camada de argila ou rochas impermeáveis, há a formação de um reservatório permanente que é uma espécie de lago subterrâneo ou aquífero. Os aquíferos que se situam abaixo de várias camadas de rochas impermeáveis ou solo são chamados de aquíferos artesianos ou confinados.
A água subterrânea pode ser extraída através de poços e é a principal fonte de água potável para grande parte da população e em muitos casos também serve para a irrigação.
3.9.1. Contaminação de águas subterrâneas
Durante muito tempo, as águas residuais foram consideradas como uma forma tradicionalmente pura de água devido a sua filtração através do solo e do tempo de residência relativamente longo na parte subterrânea. Algumas águas subterrâneas são naturalmente muito salgadas e ácidas para o consumo humano ou para uso para a irrigação, podendo conter quantidades excessivas de sódio, sulfeto ou ferro e esses contaminantes inviabilizam o seu uso em muitas outras atividades.
Até meados dos anos 1980 a humanidade somente se preocupou com a poluição de águas de rios e lagos, de forma que a contaminação de águas subterrâneas não foi reconhecida como um problema muito sério. Hoje sabemos que esse tipo de contaminação ocorreu por mais de um século, porém, não sendo visível era ignorada. A contaminação dessas águas deve-se às práticas de disposição do lixo e fossas sépticas que representam uma fonte considerável de contaminantes, como: nitrato, bactérias, vírus, detergentes e produtos de limpeza em águas subterrâneas. Enquanto as águas superficiais podem ser limpas de forma relativamente fácil, a poluição de água subterrânea é um problema mais difícil de ser solucionado.
Desta forma, a disposição não controlada de lixos orgânicos e inorgânicos representa um grave problema ambiental. Atualmente, existe maior consciência por parte das grandes corporações que se tornaram mais responsáveis no tratamento destes resíduos, bem como em sua disposição.
De modo geral, pode-se dizer que a contaminação de águas subterrâneas só aparece depois de alguns anos, da exposição aos contaminantes. As substâncias contaminantes podem ser pesticidas, herbicidas, metais entre outros. Os pesticidas orgânicos como a atrazina carreados da superfície terrestre tem-se tornado a maior preocupação referente à contaminação de aquíferos rasos.
O íon nitrato é o contaminante inorgânico de maior preocupação em águas subterrâneas localizadas próximas aos aquíferos de zonas rurais e suburbanas. Os níveis de nitrogênio podem variar dependendo do local e da profundidade dos aquíferos, e as maiores quantidades são encontradas em aquíferos mais rasos. Fontes de nitrato podem ser os fertilizantes utilizados na agricultura bem como compostos inorgânicos e de esterco animal em plantações. Atualmente, os solos intensamente cultivados, ainda que sem a aplicação de fertilizantes, podem também ser fonte de íons nitrato, porque a forma reduzida de nitrogênio torna-se oxidada no solo para nitrato, que devido a sua solubilidade é lixiviado e migrará para as águas subterrâneas. Além disso, ele pode se originar de esgoto depositado em fossas sépticas e deposição atmosférica. O nitrato proveniente da deposição atmosférica resulta de fontes como a emissão de NOx, a partir de veículos e de plantas de geração de energia. Ele pode também provir de sua forma natural, a partir das tempestades que oxidam o ar a ácido nítrico e então o neutralizam a nitrato de amônio.
Existe um potencial perigo à saúde humana se um excesso de íon nitrato for encontrado porque podem originar-se doenças como a metemoglobina em recém-nascidos, bem como em adultos que tenham uma particular deficiência em enzimas. Recentemente, pesquisas têm apontado um aumento no risco em adquirir o linfoma não Hodgkin's por pessoas que consumiam água potável com um nível de nitrato mais alto. Embora estudos recentes tenham falhado em tentar estabelecer qualquer relação positiva entre a ingestão de íons nitrato e a incidência de câncer no estômago, acredita-se que possam haver algumas evidências, mesmo que ainda não sejam comprovadas.
Alguns metais pesados como mercúrio, chumbo, crômio, cobre e cádmio, conjuntamente com outras substâncias químicas tóxicas, podem ser concentrados nos aquíferos a partir da deposição de lixo, ou eliminação de resíduos pelas indústrias e bases militares. Produtos resultantes da drenagem de minas de carvão e de metais podem também contaminar a superfície e posteriormente as águas subterrâneas.
Uma das grandes preocupações ambientais é a contaminação de águas subterrâneas por compostos orgânicos. A principal fonte dessa contaminação consiste na deposição em aterros municipais e locais de resíduos industriais. Líquidos que contêm o material dissolvido que drenam de uma fonte terrestre como um aterro, são chamados de chorume.
Dentre os contaminantes orgânicos, há os solventes clorados, como o tricloroeteno (TCE) e o percloroeteno que mais prevalecem como contaminantes orgânicos em água subterrânea. Ambos são solventes industriais usados para dissolver graxas sobre metal. O TCE é uma possível causa de câncer de fígado e pode causar distúrbio nas funções neurológicas e danos ao desenvolvimento e reprodução.
Já os hidrocarbonetos, como os compostos provenientes da gasolina e outros produtos do petróleo, dentre estes (benzeno, e seus derivados metilados: tolueno e os três isômeros do xileno e o MTBE) são os contaminantes mais comuns.
As águas subterrâneas que estão localizadas em locais onde a indústria química ou a disposição de resíduos estão instaladas encontram-se por vezes contaminadas com compostos químicos dessa classe. Também considerada um contaminante, a gasolina pode entrar no solo via derramamento superficial e uma de suas possíveis formas de contaminação deve-se ao fato de que os tanques feitos de aço ficam bastante corroídos, permitindo que parte do combustível entre em contato com o meio ambiente.
Quando os compostos orgânicos migram para o lençol freático seu comportamento dependerá em grande parte de sua densidade em relação à água (1,0 g mL-1). Aqueles que são menos densos (mais leves) flutuam sobre a superfície do lençol freático. Esses hidrocarbonetos têm uma pequena massa molecular, como por exemplo, o BTEX da gasolina, além de outros produtos do petróleo. Outros compostos, como solventes policlorados, são mais densos (mais pesados) do que a água e assim tendem a afundar nos aquíferos. Geralmente os materiais orgânicos de alto peso molecular que não são clorados, mas têm alto peso molecular, como o creosoto e o alcatrão de carvão, fazem parte do grupo dos compostos mais pesados que a água.
3.9.2. Descontaminação de água subterrânea
Para o caso de águas subterrâneas é difícil encontrar uma solução para o problema da contaminação. O controle normalmente consiste em um sistema de bombeamento e tratamento dos contaminantes orgânicos, seguido do retorno dessa água para os aquíferos ou outro corpo aquático. De outra forma, uma névoa muito fina de água subterrânea contaminada é pulverizada sobre as plantações, utilizando um sistema móvel de pulverização e com isso os compostos orgânicos voláteis evaporam no ar resultando em uma água limpa para a irrigação.
Alguns tipos de tratamentos consistem em aquecimentos in situ, para vaporizar líquidos orgânicos fazendo com que seus vapores subam à superfície, e por adição de oxidantes convertam as substâncias em produtos como o dióxido de carbono. Tipicamente, as temperaturas mais próximas de 100 oC são usadas no aquecimento, embora não se saiba se está é a temperatura ideal. O aquecimento e/ou a produção de gases ou precipitação por oxidação podem mudar condições geológicas e biológicas nas vizinhanças imediatas do tratamento com efeitos inesperados na distribuição e modalidade dos poluentes remanescentes.
Biorremediação e atenuação natural
Outro processo que pode ser aplicado para a descontaminação de água e do solo, além dos processos químicos e físicos, consiste na biorremediação que se baseia em métodos bioquímicos de remediação. Dentre os diversos processos, pode ser destacada a biodegradação de cloroeteno por bactéria. Esse processo , no entanto, é menos efetivo quanto maior for a cloração do composto e então para o caso do percloroeteno (PCE), não há aplicabilidade. Compostos como esses podem ser biodegradados sob condições anaeróbias e principalmente em meio a metanol. Deve-se salientar que um dos subprodutos consiste na formação de cloreto de vinila que é um composto carcinogênico. Pesquisas recentes descobriram uma bactéria que é capaz de remover todos os cloros de solventes orgânicos, como o do tricloroeteno e do percloroeteno (PCE).
De forma geral, constata-se que existe uma efetividade limitada de muitas tecnologias de limpeza de águas subterrâneas, com isso, o uso do processo de atenuação ambiental, seguido pelos processos biológico natural, químicos ou físicos para tratar os contaminantes em águas subterrâneas tornou-se o de maior aplicação.
Existem, no entanto, controvérsias a respeito do fato de que seja a atenuação ambiental uma estratégia apropriada para gerenciar o problema de contaminação de água subterrânea. Alguns ambientalistas acreditam que seja somente um meio alternativo de evitar os custos mais altos de limpeza da água. Em 1997, agências americanas estabeleceram um comitê para determinar quais poluentes poderiam ser tratados por essa técnica.
De acordo com os dados verificados, constatou-se que somente três poluentes são eficientes para serem tratados por atenuação: os hidrocarbonetos BTEX, os compostos orgânicos de baixo peso molecular e o cloreto de metileno. Nesses casos, a biotransformação consistiu no processo dominante para o qual a atenuação ocorre. Nenhum composto orgânico altamente clorado, como o TCE e o PCE ou mesmo o MTBE, é tratado com sucesso por esse processo, bem como o mercúrio e o íon perclorato também não são tratados eficientemente usando esta técnica.
Outras formas de tratamento de águas subterrâneas
Alguns cientistas desenvolveram uma promissora técnica para tratar águas subterrâneas contaminadas com compostos orgânicos clorados voláteis ao construírem uma parede subterrânea de material permeável (material constituído de areia grossa) colocado ao longo do caminho da água. Esse material contém ferro na forma de pequenos grânulos, que é comumente proveniente de resíduos de processos industriais. O ferro metálico quando em contato com certos compostos orgânicos clorados em água, age como um agente redutor, e se oxida formando o íon ferroso que se dissolve em água:
Fe(s) → Fe2+(aq) + 2e-
equação 3.21Os elétrons são doados para as moléculas organocloradas que estão temporariamente adsorvidas na superfície do metal; os átomos de cloro nas moléculas são consequentemente reduzidos a íons cloreto, Cl-, e liberados para dentro da solução aquosa. Por exemplo, a redução por elétrons de tricloroeteno para sua forma totalmente desclorada, eteno, pode ser escrita na forma não balanceada como:
C2HCl2(aq) → C2H4(aq) + 3Cl-(aq)
equação 3.22Balanceando a reação redox para soluções alcalinas obtemos a seguinte reação balanceada:
C2HCl2(aq) + 3H2O(l) + 6e- → C2H4(aq) + 3Cl-(aq) + 3OH-(aq)
equação 3.23A combinação das semirreações (depois de multiplicar por 3) resulta na reação global:
3Fe(s) + C2HCl2(aq) + 3H2O(l) → 3Fe2+(aq) + C2H4(aq) + 3Cl-(aq) + 3OH-(aq)
equação 3.24Como subproduto da reação redox, tem-se o íon hidróxido (OH-). No entanto, deve-se lembrar de que em áreas ricas de rochas calcárias, a concentração de bicarbonato de cálcio dissolvido é alta. Em virtude disso, os íons hidróxidos produzidos nas reações de remediação da água reagem com os íons bicarbonato para produzir os íons carbonato, CO32-, os quais se combinam com íons cálcio para produzir carbonato de cálcio (CaCO3), que então se precipita na mistura de ferro e areia. As medidas realizadas em campo indicam que esta nova tecnologia pode funcionar por vários anos, e dessa forma substituir os métodos de tratamento que usam o bombeamento da água subterrânea. A água é limpa quando passa através da parede e não tem que ser bombeada para fora do aquífero. Essa nova técnologia pode ser importantes para o tratamento de metano clorado e etano dissolvidos em águas.
Em estudos recentes, foi observado que a cobertura do material de ferro com níquel aumenta em dez vezes a velocidade de degradação de compostos orgânicos e também reduz íons Cr6+. Uma técnica para a criação in situ de ferro elementar de seus íons (Fe2+ e Fe3+) pela injeção de agentes redutores aquosos foi testada.
Outra forma de tratamento desenvolvida foi a técnica in situ para tratamento de TCE e PCE usando hidrogenação. O processo usa gás H2 dissolvido para rapidamente desclorar esses dois compostos orgânicos, eventualmente formando etano e HCl. A reação usa um catalisador de paládio e pode ser feita com a perfuração de um poço e, por isso, não necessita que a água seja trazida para a superfície.
Desenvolvendo e aplicando o conhecimento
1. Comente sobre as principais diferenças entre as águas subterrâneas e superficiais.
2. Comente sobre os principais contaminantes encontrados em águas e dê exemplos desses tipos.
3. No caso de tratamento de água, comente sobre o processo químico de desinfecção de água.
4. Comente sobre a desvantagem do uso da cloração como processo químico.
5. Comente sobre a contaminação de nitrogênio em águas subterrâneas e os perigos que representam os nitratos para a água potável.
6. Comente sobre o contaminante perclorato e qual sua forma de atuação.
7. Cite os processos físicos e químicos de tratamento de águas.
8. O que é remediação e biorremediação?
Referências
BAIRD, C.; CANN, M. Química Ambiental. 4a edição. Porto Alegre: Bookman, 2011.
SPIRO, T. G.; STIGLIANI, W. M. Química Ambiental. 2a edição. São Paulo: Pearson Pretice Hall, 2009.